题目内容
现有40℃时KNO3的饱和溶液82.0g,当温度下降至10℃时,溶液质量为60.5g,此时需加水102.4g才能把析出的晶体全部溶解,则40℃时KNO3的溶解度是( )A.32g
B.64g
C.40.5g
D.21.5g
【答案】分析:计算40℃时KNO3的溶解度则需要确定40℃时KNO3的饱和溶液中硝酸钾与水的质量关系,即判断40℃时KNO3的饱和溶液82.0g中所含硝酸钾及水的质量;由温度下降至10℃时,溶液质量为60.5g,可判断降温后析出硝酸钾的质量为21.5g;再利用此时需加水102.4g才能把析出的晶体全部溶解,可求得10℃时硝酸钾饱和溶液的溶质质量分数,从而求得10℃时溶液质量为60.5g的硝酸钾饱和溶液中所含硝酸钾的质量,即可解决40℃时KNO3的溶解度的计算.
解答:解:根据题意,当温度下降至10℃时析出硝酸钾的质量为82.0g-60.5g=21.5g,10℃时硝酸钾饱和溶液的溶质质量分数=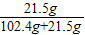 ×100%≈17.35%
×100%≈17.35%
则10℃时溶液质量为60.5g的硝酸钾饱和溶液中所含硝酸钾的质量=60.5g×17.35%=10.5g
40℃时KNO3的饱和溶液82.0g中所含硝酸钾的质量=10.5g+21.5g=32g
则40℃时KNO3的溶解度=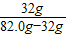 ×100g=64g
×100g=64g
故选B.
点评:解决本问题所需要明确,降温析出晶体后饱和溶液中溶质硝酸钾的质量与析出硝酸钾晶体质量和即为降温前饱和溶液中所含硝酸钾的质量.
解答:解:根据题意,当温度下降至10℃时析出硝酸钾的质量为82.0g-60.5g=21.5g,10℃时硝酸钾饱和溶液的溶质质量分数=
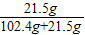 ×100%≈17.35%
×100%≈17.35%则10℃时溶液质量为60.5g的硝酸钾饱和溶液中所含硝酸钾的质量=60.5g×17.35%=10.5g
40℃时KNO3的饱和溶液82.0g中所含硝酸钾的质量=10.5g+21.5g=32g
则40℃时KNO3的溶解度=
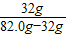 ×100g=64g
×100g=64g故选B.
点评:解决本问题所需要明确,降温析出晶体后饱和溶液中溶质硝酸钾的质量与析出硝酸钾晶体质量和即为降温前饱和溶液中所含硝酸钾的质量.

练习册系列答案
相关题目
现有40℃时KNO3的饱和溶液82.0g,当温度下降至10℃时,溶液质量为60.5g,此时需加水102.4g才能把析出的晶体全部溶解,则40℃时KNO3的溶解度是( )
| A、32g | B、64g | C、40.5g | D、21.5g |