题目内容
【题目】学习了金属的有关知识后,同学们知道了如何鉴别黄金和黄铜(铜锌合金,俗名“愚人金”),为进一步定量分析黄铜的成分,某同学进行了如下实验:称量黄铜样品20g放入锥形瓶中,向其中不断加入稀硫酸,收集生产的气体与所加稀硫酸的质量关系如图所示。求: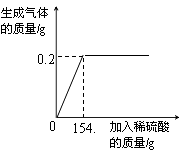
(1)黄铜样品中锌的质量
(2)恰好完全反应时,所得溶液中溶质的质量分数。
【答案】
(1)6.5g
(2)10%
【解析】解:设样品中锌的质量为x,生成硫酸锌的质量为 y,
由图分析可知产生氢气0.2g,
Zn+H2SO4=ZnSO4+H2↑
65 161 2
x y 0.2g ![]() =
= ![]() =
=![]()
x=6.5g
y=16.1g
答:样品中锌的质量为6.5g.
(2)所得硫酸锌溶液中溶质的质量分数:![]() ×100%=10%.
×100%=10%.
答:(2)所得硫酸锌溶液中溶质的质量分数为10%.
故答案为:(1)6.5g;(2)10%.
(1)锌会与稀硫酸反应生成硫酸锌和氢气,从图象中可以看出生成氢气的质量是0.2g;
(2)写出锌与稀硫酸反应的化学反应方程式,然后根据氢气的质量求出锌和硫酸锌的质量,最后根据溶质的质量分数等于溶质的质量除以溶液的质量进行解答即可.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目