题目内容
【题目】(4分)鸡蛋壳的主要成分是碳酸钙(其它成分不溶于水也不与酸反应)。化学兴趣小组为了测定鸡蛋壳中碳酸钙的含量,做如下实验:
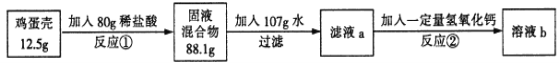
反应①结束后,所加盐酸刚好反应了一半,反应②恰好完全反应。请回答下列问题(可以选下列任意两个问题回答,并写出计算过程):
(1)反应①产生的CO2的质量为___________________;
(2)该鸡蛋壳中碳酸钙的质量分数为________________;
(3)所加氢氧化钙的质量为__________________;
(4)溶液b中溶质的质量分数为_________________;
计算过程:
【答案】(1)4.4g (2)80% (3)7.4g (4)11.1%
【解析】
试题分析:反应前加入的物质的质量:12.5g+80g==92.5g
(1)反应①结束后,生成CO2的质量:92.5g-88.1g==4.4g
(2)设在反应①中,消耗碳酸钙的质量为x,盐酸的质量为y,生成CaCl2的质量为z
CaCO3 + 2HCl == CaCl2 + H2O +CO2↑
100 73 111 44
x y z 4.4g
![]() =
= ![]() x = 10g CaCO3% =
x = 10g CaCO3% = ![]() ×100% =80%
×100% =80%
![]() =
= ![]() y = 7.3g
y = 7.3g
![]() =
= ![]() z = 11.1g
z = 11.1g
(3)设在反应②中消耗Ca(OH)2的质量为m,生成CaCl2的质量为n
Ca(OH)2 + 2HCl === CaCl2 +2 H2O
74 73 111
m 7.3g y 求得m = 7.4g y= 11.1g
2个反应后溶液的质量为:88.1g — (12.5g—10g)+ 107g +7.4g == 200g
(4)CaCl2% == ![]() ×100% =11.1%
×100% =11.1%

练习册系列答案
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
相关题目