题目内容
【题目】为了测定某石灰石样品的组成,某化学兴趣小组的同学进行了以下实验:取四份相同质量的样品分别放入四个等质量的烧杯中,然后分别加入稀盐酸(杂质不与盐酸反应),充分反应后用天平称量,记录实验数据如下:
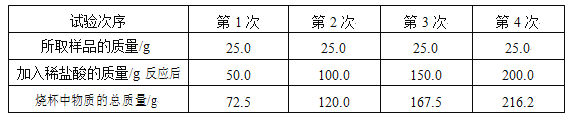
请回答下列问题并计算:
(1)经分析,在第 1 次实验结束后,反应物 完全反应完了。
(2)25.0g 样品与足量稀盐酸反应最多能生成气体 g。
(3)计算样品中碳酸钙的质量分数(写出具体计算过程)。
【答案】(1)盐酸(或稀盐酸、HCl);(2)8.8(1 分);(3)80.0%
【解析】
试题分析:(1)①由图表可知,四位同学所取样品的质量相等,每增加50.0g盐酸物质的总质量减少2.5g;而丁同学加入 200.0g盐酸与25.0g样品反应,固体质量只减少了8.8g,说明200.0g盐酸未完全反应,固体完全反应,所以第1次至第3次实验中酸反应完,固体有剩余;据质量守恒定律可知,反应前后物质的总质量不变,所以生产二氧化碳的质量即为物质总量减少的量,所以25.0g 样品与足量稀盐酸反应最多能生成气体8.8g;
解:设样品中碳酸钙的质量为 x
CaCO3+2HCl==CaCl2+H2O+CO2↑(1 分)
100 44
x 8.8g (1 分)
100/x=44/8.8g,解得 x=20.0g (1 分)
20.0g/25.0g*100%=80.0%(答“80%”不得分,1 分)
答:样品中碳酸钙的质量分数为 80.0%(1 分)。

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目