题目内容
【题目】学会物质的分离提纯和准确配制一定质量分数的溶液在实际应用中有重要意义。(已知:20℃氯化钠的溶解度为36g,水的密度可近似看作1g/mL)
实验一:溶液配制
(1)用氯化钠固体配制100g质量分数为5%的氯化钠溶液。需要氯化钠____g,水___mL。
(2)0.9%的医用氯化钠溶液俗称生理盐水,可用于补充人体所需电解质。生理盐水中的溶质为_____。
实验二:粗盐提纯
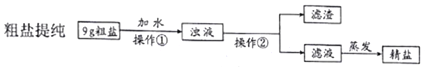
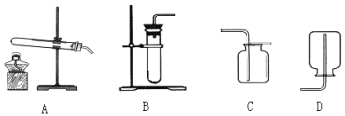
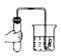
(3)操作①中玻璃棒的作用是_____,操作②的名称为_____。
(4)20℃时提纯9g粗盐,若已知粗盐中氯化钠含量约为80%,溶解时应选择哪一种规格的量筒量取所需要的水最为合适(提供的量筒规格有“10mL“”、“25mL”和“100mL”),请你选择并说明理由________。
(5)提纯后的精盐属于____(填“纯净物”或“混合物”)。
【答案】 5 95 NaCl 搅拌 过滤 25mL;粗盐中氯化钠的质量为7.2g,此温度下氯化钠全部溶解需要水20mL 混合物
【解析】(1)配制100g质量分数为5%的氯化钠溶液,需要氯化钠的质量为:100g×5%=5g,水的质量为100g-5g=95g,就是95mL;(2)生理盐水中的溶质为氯化钠;(3)据图可以看出,操作①是溶解,其中玻璃棒的作用是搅拌,操作②后得到的是固体和液体,是过滤操作;(4)粗盐中氯化钠的质量为:9g×80%=7.2g,该温度下氯化钠的溶解度为36g,故完全溶解7.2g氯化钠需要水的质量为20g,就是20mL,因此需要25mL的量筒合适;(5)提纯后的精盐只是除去了不溶性固体杂质,还含有可溶性杂质没有除去,因此属于混合物。

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案
相关题目