题目内容
下列物质中含有相同原子团的一组是( )A.Al(OH)3和NaOH
B.NaCl和KCl
C.NH4NO3和(NH4)2SO4
D.KMnO4和K2MnO4
【答案】分析:根据的原子团组成分析,相同的原子团,应是组成元素、原子个数、原子团在化合物中显示的化合价都相同,否则就不是相同的原子团.
解答:解:A、Al(OH)3和NaOH中的都含有氢氧根,都是-1价,化合价相同,所以A符合题意;
B、NaCl和KCl中不含原子团;B不符合题意;
C、NH4NO3和(NH4)2SO4中都含有相同的铵根,铵根在化合物中的化合价都是+1价,种类相同,故C正确;
B、KMnO4中的原子团是高锰酸根,在化合物中的化合价为-1价,而K2MnO4中的原子团是锰酸根,在化合物中的化合价为-2价,种类不同,故D不符合题意;
故选AC.
点评:本题考查学生对于化合物中原子团的认识,不能只从表面上原子的个数和元素的种类作判断,还要从原子团的化合价进行判断.
解答:解:A、Al(OH)3和NaOH中的都含有氢氧根,都是-1价,化合价相同,所以A符合题意;
B、NaCl和KCl中不含原子团;B不符合题意;
C、NH4NO3和(NH4)2SO4中都含有相同的铵根,铵根在化合物中的化合价都是+1价,种类相同,故C正确;
B、KMnO4中的原子团是高锰酸根,在化合物中的化合价为-1价,而K2MnO4中的原子团是锰酸根,在化合物中的化合价为-2价,种类不同,故D不符合题意;
故选AC.
点评:本题考查学生对于化合物中原子团的认识,不能只从表面上原子的个数和元素的种类作判断,还要从原子团的化合价进行判断.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案
相关题目
学习化学的过程中,常需要进行归纳总结,得出科学的结论或规律,下列是某校化学学习小组的同学提出的结论,你认为不正确的是( )
| A、分解反应的生成物中元素的化合价与反应物中元素的化合价相同 | B、含有大量OH-的溶液的pH大于7 | C、往加稀硝酸酸化的溶液中滴BaCl2溶液,生成白色沉淀,原溶液可能含SO42-或Ag+ | D、在一定温度下,溶解度不同的两种固体物质,其饱和溶液的溶质质量分数不同 |
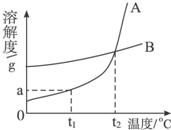 A、B两种固体物质的溶解度曲线如图所示.请完成下列问题:
A、B两种固体物质的溶解度曲线如图所示.请完成下列问题: