题目内容
【题目】如下图所示为各物质之间的转换关系,已知:B、E为黑色固体,F为红色固体,A、C、D、L为气体,G的水溶液俗称石灰水;请回答下列问题:
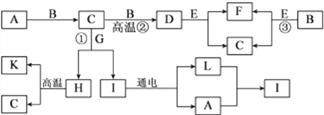
(1)写出化学式:K________,L________;
(2)写出反应①的化学方程式__________________________________________________;
(3)写出反应②的化学方程式__________________________________________________;
(4)写出反应③的化学方程式__________________________________________________;
【答案】 CaO H2 CO2 + Ca(OH)2 = CaCO3 ↓ + H2O CO2 + C = 2CO C + 2CuO =CO2 ↑ + 2Cu
【解析】G的水溶液俗称石灰水,故G是氢氧化钙,能与气体C反应,故是二氧化碳,二氧化碳与氢氧化钙反应生成碳酸钙沉淀和水,H能高温生成二氧化碳和K,故H是碳酸钙,K是氧化钙,I是水,水通电生成氢气和氧气,A能与黑色固体反应生成二氧化碳,故A是氧气,B是碳,L是氢气;二氧化碳与碳高温反应生成的D是一氧化碳,一氧化碳能与黑色固体E反应生成红色固体F,故E是氧化铜,F是铜;
(1)K是氧化钙,L是氢气,化学式为:CaO;H2;
(2)反应①是二氧化碳与氢氧化钙反应生成碳酸钙沉淀和水,该反应的化学方程式为Ca(OH)2+CO2═CaCO3↓+H2O;
(3)反应②是在高温条件下,二氧化碳和碳反应生成一氧化碳,该反应的化学方程式为CO2+C![]() 2CO;
2CO;
(4)反应③是碳和氧化铜高温反应生成铜和二氧化碳,该反应的化学方程式为,故填:C+2CuO![]() CO2 ↑ + 2Cu。
CO2 ↑ + 2Cu。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下列鉴别物质的方法,正确的是
A.木炭粉和氧化铜——观察物质的颜色
B.硬水和软水——观察颜色
C.羊毛和涤纶——灼烧,是否有烧焦羽毛的气味
D.烧碱溶液和石灰水——分别滴加无色酚酞溶液,观察颜色变化
【题目】在做实验时,欣欣需要用到200g溶质质量分数为15%的氯化钠溶液,但实验室只有50g溶质质量分数为30%的氯化钠溶液,于是她便自己动手并利用已有的溶液来配制所需的氯化钠溶液.
(1)在称量时,她需要把氯化钠固体放到天垫有纸片的(选填“左侧”或“右侧”)托盘中,并且应当称量g氯化钠固体.
(2)她把称量好的氯化钠和实验室中现有的氯化钠溶液全都转移到一个大烧杯中,并应向其中加入体积为ml的水,边加水边搅拌.(水的密度为1.0g/ml)
(3)如表是氯化钠在不同温度下的溶解度,假如她想通过升高溶液的温度来得到氯化钠晶体,则你认为她的做法(选填“可行”或“不可行”).
温度/℃ | 20 | 40 | 60 | 80 |
溶解度/g | 36.0 | 36.6 | 37.3 | 38.4 |