题目内容
“对比实验”是化学学习中行之有效的思维方法.某化学学习小组的同学在学了相关的化学知识后,走进实验室做了如下实验,请你参与并回答下列问题:
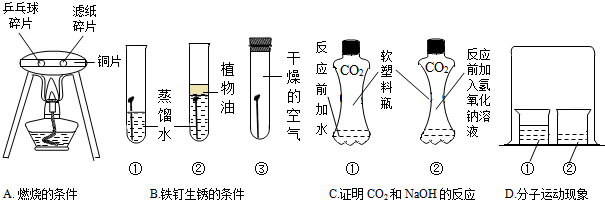
(1)通过试验A,可以说明燃烧的条件之一是 ,实验中使用铜片,是利用了铜的 性(填一条物理性质).
(2)对于实验B,一段时间观察试管①中的铁钉明显锈蚀,由此得出:铁生锈的主要条件是铁与水和 直接接触.欲除去铁锈可用 清洗
(3)实验C是利用体积相同并充满CO2的软塑料瓶、等量的水(瓶①)和NaOH溶液(瓶②)进行实验,根据塑料瓶变瘪的程度证明CO2和NaOH溶液中的溶质确实发生了反应,这一反应的化学方程式为 .

(1)通过试验A,可以说明燃烧的条件之一是
(2)对于实验B,一段时间观察试管①中的铁钉明显锈蚀,由此得出:铁生锈的主要条件是铁与水和
(3)实验C是利用体积相同并充满CO2的软塑料瓶、等量的水(瓶①)和NaOH溶液(瓶②)进行实验,根据塑料瓶变瘪的程度证明CO2和NaOH溶液中的溶质确实发生了反应,这一反应的化学方程式为
考点:燃烧与燃烧的条件,金属的物理性质及用途,金属锈蚀的条件及其防护,酸的化学性质,碱的化学性质,书写化学方程式、文字表达式、电离方程式
专题:实验性简答题
分析:(1)根据燃烧的条件以及铜具有良好的导热性进行解答;
(2)根据铁生锈的主要条件是铁与水和空气直接接触以及除去铁锈可用盐酸清洗方法进行解答;
(3)根据二氧化碳和NaOH溶液反应生成碳酸钠和水进行解答;
(2)根据铁生锈的主要条件是铁与水和空气直接接触以及除去铁锈可用盐酸清洗方法进行解答;
(3)根据二氧化碳和NaOH溶液反应生成碳酸钠和水进行解答;
解答:解:
(1)燃烧的条件:物质具有可燃性、与氧气接触、温度达到可燃物的着火点,实验A中滤纸碎片和乒乓球碎片都与氧气接触,在加热过程中,利用铜片的导热性,在中间加热,能够提供均匀的热量,由于乒乓球碎片的着火点较低,首先燃烧起来,说明燃烧需要温度达到可燃物的着火点;
故填:温度需达到可燃物的着火点;导热;
(2)对于实验B,一段时间观察试管①中的铁钉明显锈蚀,①试管中即提供了空气,也提供了水,由此得出:铁生锈的主要条件是铁与水和空气直接接触;铁制品除锈时不能长时间浸在酸溶液中,因为酸也和金属反应;故填:空气;不能;
(3)二氧化碳和NaOH溶液反应生成碳酸钠和水,故反应的化学方程式为2NaOH+CO2═Na2CO3+H2O;
故答案为:
(1)温度需达到可燃物的着火点;导热;
(2)空气;盐酸;
(3)2NaOH+CO2═Na2CO3+H2O
(1)燃烧的条件:物质具有可燃性、与氧气接触、温度达到可燃物的着火点,实验A中滤纸碎片和乒乓球碎片都与氧气接触,在加热过程中,利用铜片的导热性,在中间加热,能够提供均匀的热量,由于乒乓球碎片的着火点较低,首先燃烧起来,说明燃烧需要温度达到可燃物的着火点;
故填:温度需达到可燃物的着火点;导热;
(2)对于实验B,一段时间观察试管①中的铁钉明显锈蚀,①试管中即提供了空气,也提供了水,由此得出:铁生锈的主要条件是铁与水和空气直接接触;铁制品除锈时不能长时间浸在酸溶液中,因为酸也和金属反应;故填:空气;不能;
(3)二氧化碳和NaOH溶液反应生成碳酸钠和水,故反应的化学方程式为2NaOH+CO2═Na2CO3+H2O;
故答案为:
(1)温度需达到可燃物的着火点;导热;
(2)空气;盐酸;
(3)2NaOH+CO2═Na2CO3+H2O
点评:此题是一道综合性的实验设计题,解题的关键是掌握燃烧的条件、铁生锈的条件、二氧化碳的性质、微粒的性质并进行知识的大胆迁移,只有这样才能顺利解题.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
已知金属元素R(只有一种化合价)氧化物的化学式为R2O3,则它的氯化物的化学式为( )
| A、RCl2 |
| B、RCl3 |
| C、R2Cl3 |
| D、RCl |
化学使世界变得更加绚丽多彩,社会的文明和进步离不开化学.下列事实中与化学无关的是( )
| A、发展低碳经济,保护环境 |
| B、指南针的发明与利用 |
| C、开发新能源,研制新材料 |
| D、药物和保健品的研制 |
 联合国第63届大会决定将2011年作为国际化学年(IYC2011),其主题是“化学--人类的生活,人类的未来”.请回答下列化学与人类生活相关的问题.
联合国第63届大会决定将2011年作为国际化学年(IYC2011),其主题是“化学--人类的生活,人类的未来”.请回答下列化学与人类生活相关的问题.