题目内容
化学综合实践活动小组的同学,对一造纸厂排放的污水进行检测,发现其主要的污染物无氢氧化钠.为了测定污水中氢氧化钠的含量,他们首先用溶质质量分数为20%盐酸,配制溶质质量分数为5%的稀盐酸200g.然后取80g污水于烧杯中,逐滴加入这种稀盐酸至73g时两者恰好完全反应(污水中的其他成分不与稀盐酸反应).
试计算:
(1)配制稀盐酸时,需溶质质量分数为20%的盐酸多少克?
(2)污水中所含氢氧化钠的质量分数是多少?
解:(1)据:溶质质量混合前后相等,设需溶质质量分数为20%的盐酸质量为x,则:
x×20%=200g×5%
解得:x=50g
(2)消耗的73.0g盐酸中含氯化氢的质量为:73.0g×5%=3.65g,
设污水中含量NaOH质量为y,
HCl+NaOH═NaCl+H2O
36.5 40
3.65g y
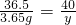
解得:y=4g
所以污水中所含氢氧化钠的质量分数是: ×100%=5%
×100%=5%
答:(1)配制稀盐酸时,需溶质质量分数为20%的盐酸50g;
(2)污水中所含氢氧化钠的质量分数是5%.
分析:(1)根据溶液稀释前后溶质的质量不变来完成该题的解答;
(2)根据盐酸和氢氧化钠反应的化学方程式,利用消耗的盐酸的质量可以求算出氢氧化钠的质量,进而可以计算出氢氧化钠溶液的质量分数.
点评:本题主要考查了根据化学方程式进行的有关计算,解答时、理清各物质的关系正确的书写化学方程式,找准质量关系并列比例式求算即可.
x×20%=200g×5%
解得:x=50g
(2)消耗的73.0g盐酸中含氯化氢的质量为:73.0g×5%=3.65g,
设污水中含量NaOH质量为y,
HCl+NaOH═NaCl+H2O
36.5 40
3.65g y
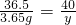
解得:y=4g
所以污水中所含氢氧化钠的质量分数是:
 ×100%=5%
×100%=5%答:(1)配制稀盐酸时,需溶质质量分数为20%的盐酸50g;
(2)污水中所含氢氧化钠的质量分数是5%.
分析:(1)根据溶液稀释前后溶质的质量不变来完成该题的解答;
(2)根据盐酸和氢氧化钠反应的化学方程式,利用消耗的盐酸的质量可以求算出氢氧化钠的质量,进而可以计算出氢氧化钠溶液的质量分数.
点评:本题主要考查了根据化学方程式进行的有关计算,解答时、理清各物质的关系正确的书写化学方程式,找准质量关系并列比例式求算即可.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目