题目内容
【题目】常温下,向某浓度的硫酸溶液中逐滴滴入某浓度的氢氧化钡溶液,生成沉淀的质量与加入氢氧化钡溶液的体积关系如图所示.a、b、c、d分别表示实验时不同阶段的反应结果,下列说法中正确的是
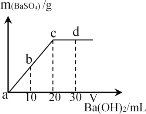
A. 溶液的导电能力:a > b > c > d
B. 溶液的pH大小:a< b < c < d
C. a、c溶液呈酸性
D. c、d溶液呈碱性
【答案】B
【解析】
向硫酸中滴加氢氧化钡,二者反应生成硫酸钡沉淀和水。硫酸呈酸性,水呈中性,氢氧化钡呈碱性。溶液的导电能力与溶液中离子浓度有关,溶液中离子浓度越大,导电能力越强。
A、从a到c反应过程中,随着反应的进行溶液中离子浓度逐渐减少,导电性也逐渐减弱,到c点时两物质恰好完全反应,导电性几乎为零,再滴加氢氧化钡溶液,离子浓度逐渐增大,导电性逐渐增强,故导电能力c点最弱,故A错误。
B、a点时,溶液中只有硫酸,硫酸呈酸性,pH值小于7;b点时,随着氢氧化钡的滴入,硫酸浓度逐渐减小,pH值逐渐增大,但仍小于7;c点时,硫酸与氢氧化钡恰好完全反应,溶液呈中性,pH值等于7;d点时,氢氧化钡过量时,溶液呈碱性,pH值大于7。故溶液的pH大小:a< b < c < d,故B正确;
C. a溶液呈酸性,c溶液呈中性,故C错误;
D、c溶液呈中性,d溶液呈碱性,故D错误。故选B。

练习册系列答案
相关题目