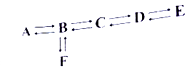题目内容
【题目】金属材料广泛应用于生产生活中.
(1)铝块能制成铝箔是利用了铝的性(填“导电”或“延展”).
(2)为探究铝、铜的金属活动性顺序,某同学选用了下列药品进行实验,其中可行的是(填字母).
A.铝丝、铜丝、氯化镁溶液
B.铝丝、铜丝、硫酸铜溶液
(3)A~G是初中化学常见的物质.己知A为黑色固体单质,B为红棕色粉末,G为紫红色固体单质,它们的转化关系如图所示,回答问题. 
①写出化学式:A;B .
②反应Ⅱ的化学方程式为 .
③反应Ⅲ的化学方程式为 .
(4)用1600t含氧化铁80%的赤铁矿石,理论上可以炼出含铁96%的生铁的质量为t (结果保留至0.1).
【答案】
(1)延展
(2)B
(3)C;Fe2O3;CO2+C ![]() 2CO;Fe+CuSO4=FeSO4+Cu
2CO;Fe+CuSO4=FeSO4+Cu
(4)933.3
【解析】解:(1)利用金属铝具有良好的延展性可把金属铝制成片;所以答案是:延展;(2)A、铝、铜都不能和氯化镁反应,因此不能比较二者金属活动性顺序;B、铝可以和硫酸铜溶液反应置换出铜,证明铝比铜活泼,可以验证铝、铜的金属活动性顺序;B;(3)G为紫红色固体单质,则G是铜,A为黑色固体单质,B为红棕色粉末,A和B高温能反应生成C和D,则A可能是碳,B可能是氧化铁,生成的D能与硫酸铜反应铜,则D是铁,C是二氧化碳,C能与A反应生成E,则E是一氧化碳,一氧化碳能与F反应生成铜,则F是氧化铜,代入框图,推断合理;①A是碳,B是氧化铁,化学式分别为:C;Fe2O3;②应Ⅱ是二氧化碳和碳高温产生一氧化碳,方程式为:CO2+C ![]() 2CO;③反应Ⅲ为铁能与硫酸铜反应生成铜和硫酸亚铁,故反应的化学方程式:Fe+CuSO4═FeSO4+Cu; 所以答案是:①C;Fe2O3;②CO2+C
2CO;③反应Ⅲ为铁能与硫酸铜反应生成铜和硫酸亚铁,故反应的化学方程式:Fe+CuSO4═FeSO4+Cu; 所以答案是:①C;Fe2O3;②CO2+C ![]() 2CO;③Fe+CuSO4=FeSO4+Cu;(4)解:设理论上可炼出含铁96%的生铁质量为x.
2CO;③Fe+CuSO4=FeSO4+Cu;(4)解:设理论上可炼出含铁96%的生铁质量为x.
Fe2O3+3CO | 2Fe+3CO2 |
160 | 112 |
1600t×80% | 96%x |
![]() =
= ![]()
解得:x=933.3t;933.3.
【考点精析】认真审题,首先需要了解金属的物理性质及用途(金属的物理性质: (1)常温下一般为固态(汞为液态),有金属光泽.(2)大多数呈银白色(铜为紫红色,金为黄色)(3)有良好的导热性、导电性、延展性),还要掌握金属活动性顺序及其应用(在金属活动性顺序里:1、金属的位置越靠前,它的活动性就越强2、位于氢前面的金属能置换出盐酸、稀硫酸中的氢(不可用浓硫酸、硝酸)3、位于前面的金属能把位于后面的金属从它们的盐溶液中置换出来.(除K、Ca、Na))的相关知识才是答题的关键.

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案