题目内容
(13分)下表是KNO3和NaCl在一定温度(t℃)的溶解度(g)。回答下列问题
小题1:根据上表数据绘制KNO3和NaCl的溶解度曲线。

小题2:在 ℃KNO3和NaCl两种物质的溶解度相等。
小题3:95℃时,在248g溶液中含有110g的KNO3和38g的NaCl,溶液中水的质量为 g。将95℃的溶液降温到70℃,过滤。保持过滤液温度仍为70℃,过滤液中的阳离子是 。过滤出的固体是 ,质量约为 g。
小题4:将上述70℃的过滤液再冷却到20℃,过滤。保持过滤液温度为20℃,则过滤液中的溶质是 。过滤出的固体是 ,质量约为 g。
 温度(℃) 温度(℃)溶解度(g) | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 37.8 | 38.4 |
| KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 | 169 |

小题2:在 ℃KNO3和NaCl两种物质的溶解度相等。
小题3:95℃时,在248g溶液中含有110g的KNO3和38g的NaCl,溶液中水的质量为 g。将95℃的溶液降温到70℃,过滤。保持过滤液温度仍为70℃,过滤液中的阳离子是 。过滤出的固体是 ,质量约为 g。
小题4:将上述70℃的过滤液再冷却到20℃,过滤。保持过滤液温度为20℃,则过滤液中的溶质是 。过滤出的固体是 ,质量约为 g。
小题1:

小题2:23℃ (1分)
小题3:100 (1分) K+ Na+ (2分)NaCl(1分) 0.2 (1分)
小题4: NaCl KNO3 , (2分) NaCl KNO3 , (2分)80.2(1分)
分析:(1)根据图表提供的不同温度下物质的溶解度绘制硝酸钾和氯化钠的溶解度曲线;
(2)根据溶解度曲线图:两种物质溶解度曲线的交点表示该温度下两物质的溶解度相同;
(3)根据溶液的质量=溶质的质量+溶剂的质量分析解答;并根据氯化钠和硝酸钾在70℃时的溶解度分析解答;
(4)根据20℃时硝酸钾、氯化钠的溶解度判断滤液中的溶质和析出晶体的质量.
解答:解:(1)氯化钠和硝酸钾的溶解度曲线为:
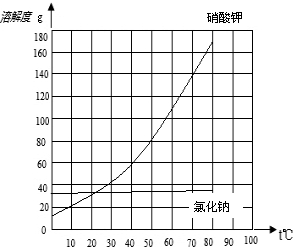
(2)由溶解度曲线可知:约在23℃时两物质的溶解度相交于一点,溶解度相同;
故答案为:23℃;
(3)在248g溶液中含有110g的KNO3和38g的NaCl,溶液中水的质量为248g-110g-38g=100g;
在70℃时氯化钠的溶解度是37.8g,硝酸钾的溶解度是138g,所以当降到70℃时有氯化钠析出,质量为38g-37.8g-0.2g,此时形成的是硝酸钾的不饱和溶液,氯化钠的饱和溶液;
故答案为:100; K+、Na+; NaCl; 0.2;
(4)将上述70℃的过滤液再冷却到20℃,过滤.保持过滤液温度为20℃,20℃时氯化钠的溶解度是36g,硝酸钾的溶解度是31.6g;则过滤液中的溶质是硝酸钾和氯化钠,析出氯化钠的质量是37.8g-36.0g=1.8g,析出的硝酸钾的质量为:110g-31.6g=79.4g,则过滤出的固体的质量是:1.8g+79.4g=80.2g;
故答案为:NaCl、KNO3; NaCl、KNO3;80.2.
(2)根据溶解度曲线图:两种物质溶解度曲线的交点表示该温度下两物质的溶解度相同;
(3)根据溶液的质量=溶质的质量+溶剂的质量分析解答;并根据氯化钠和硝酸钾在70℃时的溶解度分析解答;
(4)根据20℃时硝酸钾、氯化钠的溶解度判断滤液中的溶质和析出晶体的质量.
解答:解:(1)氯化钠和硝酸钾的溶解度曲线为:

(2)由溶解度曲线可知:约在23℃时两物质的溶解度相交于一点,溶解度相同;
故答案为:23℃;
(3)在248g溶液中含有110g的KNO3和38g的NaCl,溶液中水的质量为248g-110g-38g=100g;
在70℃时氯化钠的溶解度是37.8g,硝酸钾的溶解度是138g,所以当降到70℃时有氯化钠析出,质量为38g-37.8g-0.2g,此时形成的是硝酸钾的不饱和溶液,氯化钠的饱和溶液;
故答案为:100; K+、Na+; NaCl; 0.2;
(4)将上述70℃的过滤液再冷却到20℃,过滤.保持过滤液温度为20℃,20℃时氯化钠的溶解度是36g,硝酸钾的溶解度是31.6g;则过滤液中的溶质是硝酸钾和氯化钠,析出氯化钠的质量是37.8g-36.0g=1.8g,析出的硝酸钾的质量为:110g-31.6g=79.4g,则过滤出的固体的质量是:1.8g+79.4g=80.2g;
故答案为:NaCl、KNO3; NaCl、KNO3;80.2.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目






