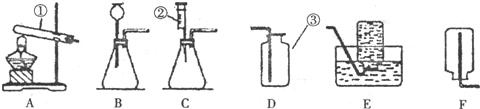
题目内容
化学活动小组的同学在探究金属的化学性质时,发现铜与稀硫酸在常温或短时间加热的条件下均不反应,那么铜与浓硫酸能否反应呢?
[猜想与假设]
猜想①在常温下能反应.
猜想②________.
猜想③________.
[设计方案]
①将一小块铜片放入试管中,加入浓硫酸无明显现象
②加热该试管,铜片上有气泡产生,并闻到刺激性气味
③检验产生的有刺激性气味的气体(检验方法及现象略)
④立即停止加热
⑤将试管的残液慢慢倒入少量水中,溶液呈蓝色
[结论]
(1)由以上探究可知:猜想________是正确的.
(2)经检验产生的气体是SO2,立即停止加热,可将多余的SO2用________溶液来吸收,反应方程式是________.
(3)铜与浓硫酸在加热条件下反应的产物是SO2和CuSO4.
[反思与评价]
(1)操作⑤中,从安全角度考虑(填“能”或“不能”)________将水倒入剩余的液体里,理由是________.
(2)探究结论中对产物是SO2和CuSO4的判断是否正确?________,理由是________.请写出正确的铜与浓硫酸在加热条件下反应的化学方程式________.
[拓展与应用]
根据以上探究和已掌握知识,同学们设计了两个利用废铜屑、硫酸为原料制取硫酸铜的实验方案.
甲方案:利用废铜屑与浓硫酸在加热条件下反应制取硫酸铜.
乙方案:在加热条件下将废铜屑在空气中氧化成氧化铜,再将氧化铜与稀硫酸的反应制取硫酸铜.
请你从安全、节约、环保等方面进行评价较好方案是________.
理由是(答一个即可)________.
解:Ⅰ.[猜想与假设]做出的猜想有:在常温下不能反应,但在加热条件下能反应;在加热条件下也不能反应;故答案为:猜想②在常温下不能反应,但在加热条件下能反应;猜想③在加热条件下也不能反应;
Ⅱ.[结论]根据实验现象可知,在加热的条件下,铜与浓硫酸反应,猜想②准确;二氧化硫可以用氢氧化钠溶液吸收,二氧化硫与氢氧化钠反应生成亚硫酸钠和水,配平即可;故答案为:(1)②(2)氢氧化钠;SO2+2NaOH=Na2SO3+H2O
Ⅲ.[反思与评价]浓硫酸溶于水要放出大量的热且密度比水大,稀释时要将浓硫酸倒入水中,试管中的残液含有浓硫酸,故不能将水倒入残液中;根据质量守恒定律,化学反应前后元素的种类不变,反应物为铜与浓硫酸,含铜、氢、硫、氧元素,反应后也应该含铜、氢、硫、氧元素,若只生成二氧化硫和硫酸铜,则元素不守恒;铜和浓硫酸反应生成硫酸铜和水和二氧化硫,配平即可;故答案为:(1)不能;如果浓硫酸有剩余,溶于水放热,比较危险;(2)不正确;反应前后元素种类不同(或生成物中不含氢元素);Cu+2H2SO4(浓) CuSO4+2H2O+SO2↑
CuSO4+2H2O+SO2↑
Ⅳ.[拓展与应用]乙方案用稀硫酸,比较安全;硫酸的利用率比甲高;没有污染空气的SO2生成等;故答案为:乙方案;不产生有害气体二氧化硫;
分析:根据提供的信息分析回答:浓硫酸具有强氧化性,可以在加热的条件下与铜反应生成硫酸铜、二氧化硫和水,二氧化硫是有毒的气体,浓硫酸溶于水要放出大量的热且密度比水大,稀释时要将浓硫酸倒入水中.乙方案好,因为乙方案用稀硫酸,比较安全;硫酸的利用率比甲高;没有污染空气的SO2生成.
点评:本题属于实验设计题,排在氢后的金属不与酸发生置换反应,但是可以和强氧化性的酸反应,浓硫酸具有强氧化性,完成本题,可以从题干给出的内容,提取有用的信息,分析归纳从而得出合理的答案,本考点主要出现在实验题中.
Ⅱ.[结论]根据实验现象可知,在加热的条件下,铜与浓硫酸反应,猜想②准确;二氧化硫可以用氢氧化钠溶液吸收,二氧化硫与氢氧化钠反应生成亚硫酸钠和水,配平即可;故答案为:(1)②(2)氢氧化钠;SO2+2NaOH=Na2SO3+H2O
Ⅲ.[反思与评价]浓硫酸溶于水要放出大量的热且密度比水大,稀释时要将浓硫酸倒入水中,试管中的残液含有浓硫酸,故不能将水倒入残液中;根据质量守恒定律,化学反应前后元素的种类不变,反应物为铜与浓硫酸,含铜、氢、硫、氧元素,反应后也应该含铜、氢、硫、氧元素,若只生成二氧化硫和硫酸铜,则元素不守恒;铜和浓硫酸反应生成硫酸铜和水和二氧化硫,配平即可;故答案为:(1)不能;如果浓硫酸有剩余,溶于水放热,比较危险;(2)不正确;反应前后元素种类不同(或生成物中不含氢元素);Cu+2H2SO4(浓)
 CuSO4+2H2O+SO2↑
CuSO4+2H2O+SO2↑Ⅳ.[拓展与应用]乙方案用稀硫酸,比较安全;硫酸的利用率比甲高;没有污染空气的SO2生成等;故答案为:乙方案;不产生有害气体二氧化硫;
分析:根据提供的信息分析回答:浓硫酸具有强氧化性,可以在加热的条件下与铜反应生成硫酸铜、二氧化硫和水,二氧化硫是有毒的气体,浓硫酸溶于水要放出大量的热且密度比水大,稀释时要将浓硫酸倒入水中.乙方案好,因为乙方案用稀硫酸,比较安全;硫酸的利用率比甲高;没有污染空气的SO2生成.
点评:本题属于实验设计题,排在氢后的金属不与酸发生置换反应,但是可以和强氧化性的酸反应,浓硫酸具有强氧化性,完成本题,可以从题干给出的内容,提取有用的信息,分析归纳从而得出合理的答案,本考点主要出现在实验题中.

练习册系列答案
相关题目