题目内容
(7分)利用金属及金属活动性顺序的有关知识解决下列问题。
(1)某兴趣小组的同学学习了金属的性质后,在实验室找到的一种银白色金属R做如下探究:
①将金属R投入稀盐酸中,金属表面有气泡冒出。则该金属R在金属活动性顺序表中排在氢的 (选填“前面”或“后面”)。
②将金属R投入到FeSO4溶液中,金属R表面有黑色物质析出。根据上述信息,判断金属Fe、R、Cu活动性由强到弱的顺序是 。
(2)工业生产中常用10%的稀盐酸来除铁制品表面的铁锈,写出盐酸除铁锈反应的化学方程式 ;若要配制该盐酸600g,则需要溶质质量分数为40%的浓盐酸(密度为1.2g/mL) mL。
(3)某校实验室废水中含有Zn(NO3) 2、AgNO3、Cu(NO3) 2三种物质。该校化学兴趣小组的同学为了从中分离、回收金属Ag和Cu,设计了如下实验方案(实验中未引进其它金属离子):
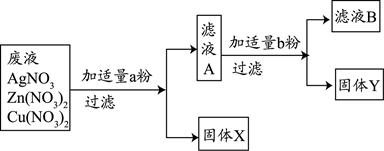
回答问题:
①固体X是 。
②写出实验过程中所发生反应的化学方程式 。
(1)某兴趣小组的同学学习了金属的性质后,在实验室找到的一种银白色金属R做如下探究:
①将金属R投入稀盐酸中,金属表面有气泡冒出。则该金属R在金属活动性顺序表中排在氢的 (选填“前面”或“后面”)。
②将金属R投入到FeSO4溶液中,金属R表面有黑色物质析出。根据上述信息,判断金属Fe、R、Cu活动性由强到弱的顺序是 。
(2)工业生产中常用10%的稀盐酸来除铁制品表面的铁锈,写出盐酸除铁锈反应的化学方程式 ;若要配制该盐酸600g,则需要溶质质量分数为40%的浓盐酸(密度为1.2g/mL) mL。
(3)某校实验室废水中含有Zn(NO3) 2、AgNO3、Cu(NO3) 2三种物质。该校化学兴趣小组的同学为了从中分离、回收金属Ag和Cu,设计了如下实验方案(实验中未引进其它金属离子):

回答问题:
①固体X是 。
②写出实验过程中所发生反应的化学方程式 。
(1)①前面 ② R Fe Cu
(2)Fe2O3 + 6HCl = 2FeCl3 + 3H2O 125
(3)①Ag
②Cu+2AgNO3=2Ag+Cu(NO3)2 Zn+Cu(NO3)2=Cu+Zn(NO3)2(2分,各1分)
(2)Fe2O3 + 6HCl = 2FeCl3 + 3H2O 125
(3)①Ag
②Cu+2AgNO3=2Ag+Cu(NO3)2 Zn+Cu(NO3)2=Cu+Zn(NO3)2(2分,各1分)
试题分析:(1)金属活动性顺序:K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au。排在氢前面的金属能从酸中置换出氢,排在前面的金属能把后面金属从其盐溶液中置换出来。故:
①将金属R投入稀盐酸中,金属表面有气泡冒出。则该金属R在金属活动性顺序表中排在氢的前面;
②将金属R投入到FeSO4溶液中,金属R表面有黑色物质析出。根据上述信息,判断金属Fe、R、Cu活动性由强到弱的顺序是R Fe Cu;
(2)盐酸除铁锈反应的化学方程式:Fe2O3 + 6HCl = 2FeCl3 + 3H2O;
设:若要配制该盐酸600g,则需要溶质质量分数为40%的浓盐酸(密度为1.2g/mL)的体积为XmL。则600×10%=X·1.2×40%,X=125ml。
(3)①由金属活动性顺序:K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au可知,Zn﹥Cu﹥Ag;加入a粉后,先辈置换出来的是Ag;故X是Ag;
②因实验中未引进其它金属离子,故加入的a粉应该是Cu,b粉应该是Zn;故反应的化学方程式有:Cu+2AgNO3=2Ag+Cu(NO3)2 Zn+Cu(NO3)2=Cu+Zn(NO3)2
点评:识记金属活动性顺序:K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au;浓溶液稀释成稀溶液后,溶质的质量不变。

练习册系列答案
相关题目