题目内容
(2010?资阳)根据下列实验要求完成作答:
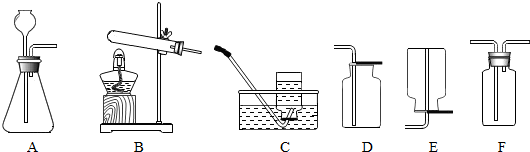
(1)实验室通常用
(2)用质量分数为98%、密度为1.84g/cm3的浓硫酸配制250mL、质量分数为20%、密度为1.14g/cm3的稀硫酸,必须要用到的下列仪器有
①天平 ②量筒 ③玻棒 ④烧瓶 ⑤烧杯.

(1)实验室通常用
大理石(或石灰石)和稀盐酸
大理石(或石灰石)和稀盐酸
(填物质名称)反应制取CO2;如图所示的下列实验装置单元中,可用作CO2制气装置的是(选填序号,后同)A
A
,可用于收集CO2的装置是DF
DF
.(2)用质量分数为98%、密度为1.84g/cm3的浓硫酸配制250mL、质量分数为20%、密度为1.14g/cm3的稀硫酸,必须要用到的下列仪器有
②③⑤
②③⑤
;①天平 ②量筒 ③玻棒 ④烧瓶 ⑤烧杯.
分析:(1)根据实验室制取二氧化碳的药品,发生装置的选择方法,二氧化碳的密度和溶解性考虑收集方法;(2)根据用液体配液体的基本步骤考虑.
解答:解:(1)实验室制取二氧化碳的药品一般用大理石(或石灰石)和稀盐酸,因为反应物是固体和液体,所以反应时不需要加热,发生装置选择没有酒精灯的A;由于二氧化碳能溶于水,不能用排水法收集,密度比空气大,可以用向上排空气法收集,所以可以用D或F来收集二氧化碳;
(2)用浓硫酸配稀硫酸,都属于液体,没有固体,不需要称量,先计算出需要浓硫酸的体积,需要水的体积,用量筒量出水的体积倒入烧杯中,再将量取的浓硫酸沿着烧杯壁慢慢倒入盛有水的烧杯中,并用玻璃棒搅拌,所以用到的仪器有:量筒;玻璃棒;烧杯.
故答案为:(1)大理石(或石灰石)和稀盐酸;A;DF; (2)②③⑤.
(2)用浓硫酸配稀硫酸,都属于液体,没有固体,不需要称量,先计算出需要浓硫酸的体积,需要水的体积,用量筒量出水的体积倒入烧杯中,再将量取的浓硫酸沿着烧杯壁慢慢倒入盛有水的烧杯中,并用玻璃棒搅拌,所以用到的仪器有:量筒;玻璃棒;烧杯.
故答案为:(1)大理石(或石灰石)和稀盐酸;A;DF; (2)②③⑤.
点评:解答本题关键是要知道发生装置的选择与反应物的状态有关,收集方法的选择与气体的溶解性和密度有关,知道浓硫酸稀释成稀硫酸时不需要称量,用到量筒;玻璃棒;烧杯等仪器.

练习册系列答案
相关题目
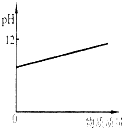 (2006?资阳)常温下,分别将少量下列物质溶于水中形成溶液,随着溶入质量的增加有如图所示的变化.下列物质溶入水中形成溶液,符合图示变化的是( )
(2006?资阳)常温下,分别将少量下列物质溶于水中形成溶液,随着溶入质量的增加有如图所示的变化.下列物质溶入水中形成溶液,符合图示变化的是( )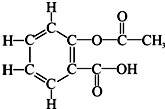 (2010?资阳)阿斯匹林又叫乙酰水杨酸,是人类常用的具有解热和镇痛等作用的一种药物,该药问市已有百多年历史.阿斯匹林的分子结构如图所示.
(2010?资阳)阿斯匹林又叫乙酰水杨酸,是人类常用的具有解热和镇痛等作用的一种药物,该药问市已有百多年历史.阿斯匹林的分子结构如图所示.