题目内容
 水是生命之源,海洋是生命的摇篮.国家海洋局在2004年中国海洋环境质量公报中发布,我国全海域海水水质污染加剧.开发海洋,维持海洋的可持续发展是每个地球公民的神圣职责.请回答下面关于海洋的几个问题:
水是生命之源,海洋是生命的摇篮.国家海洋局在2004年中国海洋环境质量公报中发布,我国全海域海水水质污染加剧.开发海洋,维持海洋的可持续发展是每个地球公民的神圣职责.请回答下面关于海洋的几个问题:
(1)海水中资源丰富,含量最多的金属阳离子是______(填离子符号).
(2)2006年6月初,渤海海域再次发生大面积赤潮.赤潮频发的主要原因之一是由于水体富营养化造成藻类疯长.某种藻类的主要化学成分为C106H263O110N16P,成分中C、N原子的个数比为______;与藻类疯长的密切相关的元素是______(填元素符号).
(3)我国舟山盐场利用海水晒盐的原理是______.(填序号)
A.氯化钠的溶解度受温度影响较大,故采取冷却热饱和溶液的方法.
B.因氯化钠溶解度受温度影响不大,故采取蒸发水分的方法.
所得粗盐中主要含泥砂、氯化镁、氯化钙等杂质,现对其进行提纯,主要操作流程如下:

操作①的名称是______,操作②的名称是______.
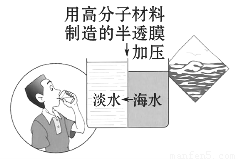
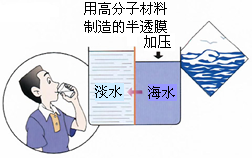
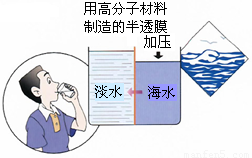
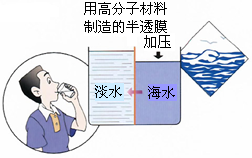
(4)海水淡化是国际上研究的热点问题,我国科学家在利用高分子膜进行海水淡化的研究上取得了一些成绩.
如图,右侧为海水,左侧为经过一段时间后由右侧经高分子膜渗透得到的淡水,分析高分子膜必须具有的性是______.
解:(1)因为海水中所含化学物质最多的是H2O,其次就是NaCl,
故答案为:Na+
(2)因为藻类的主要化学成分为C106H263O110N16P,所以成分中C、N原子的个数比=106:16=53:8,N、P、K是植物生长的营养元素,故答案为:53:8 N、P
(3)因为氯化钠的溶解度受温度影响比较小,所以应用蒸发结晶的方法使其析出来,所以应选择B;
由粗盐制得精盐的流程为:粗盐经溶解、过滤后得到NaCl、MgCl2、CaCl2的混合溶液(即滤液甲),向其中加入过量的NaOH溶液(即A溶液),经过滤此时得到Mg(OH)2、Ca(OH)2沉淀和NaCl溶液、剩余的NaOH溶液(即滤液乙),在向其中家过量的盐酸(即B溶液),中和多余的NaOH溶液,使其转化为NaCl溶液,因为盐酸受热易挥发,所以加热蒸发最后的溶液即可制得纯净的食盐.
故选B 过滤 蒸发
(4)观察题中所给图可知高分子膜允许水分子通过,而其他离子无法通过,
故答案为:高分子膜允许水分子通过,而其他离子无法通过.
分析:(1)根据海水中的主要物质分析;
(2)根据化学式中元素个数计算方法计算,再结合赤潮的原因;
(3)根据氯化钠的溶解度受温度影响分析,再结合实验室常见操作分析;
(4)结合题意,利用所学知识作答.
点评:当物质的溶解度受温度影响不大时用加热蒸发的方法使其结晶出来;当物质的溶解度受温度影响比较大时用冷却热饱和溶液的方法使其结晶出来.
故答案为:Na+
(2)因为藻类的主要化学成分为C106H263O110N16P,所以成分中C、N原子的个数比=106:16=53:8,N、P、K是植物生长的营养元素,故答案为:53:8 N、P
(3)因为氯化钠的溶解度受温度影响比较小,所以应用蒸发结晶的方法使其析出来,所以应选择B;
由粗盐制得精盐的流程为:粗盐经溶解、过滤后得到NaCl、MgCl2、CaCl2的混合溶液(即滤液甲),向其中加入过量的NaOH溶液(即A溶液),经过滤此时得到Mg(OH)2、Ca(OH)2沉淀和NaCl溶液、剩余的NaOH溶液(即滤液乙),在向其中家过量的盐酸(即B溶液),中和多余的NaOH溶液,使其转化为NaCl溶液,因为盐酸受热易挥发,所以加热蒸发最后的溶液即可制得纯净的食盐.
故选B 过滤 蒸发
(4)观察题中所给图可知高分子膜允许水分子通过,而其他离子无法通过,
故答案为:高分子膜允许水分子通过,而其他离子无法通过.
分析:(1)根据海水中的主要物质分析;
(2)根据化学式中元素个数计算方法计算,再结合赤潮的原因;
(3)根据氯化钠的溶解度受温度影响分析,再结合实验室常见操作分析;
(4)结合题意,利用所学知识作答.
点评:当物质的溶解度受温度影响不大时用加热蒸发的方法使其结晶出来;当物质的溶解度受温度影响比较大时用冷却热饱和溶液的方法使其结晶出来.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 24、水是生命之源,海洋是生命的摇篮.国家海洋局在2004年中国海洋环境质量公报中发布,我国全海域海水水质污染加剧.开发海洋,维持海洋的可持续发展是每个地球公民的神圣职责.请回答下面关于海洋的几个问题:
24、水是生命之源,海洋是生命的摇篮.国家海洋局在2004年中国海洋环境质量公报中发布,我国全海域海水水质污染加剧.开发海洋,维持海洋的可持续发展是每个地球公民的神圣职责.请回答下面关于海洋的几个问题: