题目内容
(2004?宿迁)室温下某气体可能是由SO2、CO、N2中的一种或几种组成,测得该气体中氧元素的质量分数为50%,则该气体可能为下列组成中的①SO2;②SO2、CO;③SO2、N2;④CO、N2;⑤SO2、CO、N2( )
【答案】分析:此题给定混合物中某元素的质量分数,推测混合物的组成.可采用平均值法,即某个平均量M由若干个量决定时,如果若干个量中最小量为M1,最大量为M2,则其平均值一定在M1与M2之间,即M1<M<M2.此题中50%为混合气体中氧元素质量分数的平均值,且SO2中氧元素的质量分数正好为50%,则如果含CO(氧元素质量分数大于50%),就一定含N2;而不可能出现SO2与N2、SO2与CO的组合.
解答:解:因为 SO2中氧元素的质量分数= ×100%=50%;CO中氧元素的质量分数=
×100%=50%;CO中氧元素的质量分数=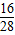 ×100%=57%;N2中氧元素的质量分数为0.
×100%=57%;N2中氧元素的质量分数为0.
题中50%为混合气体中氧元素质量分数的平均值;
所以该气体可能为:可能是SO2;也可以一种大于50%一种小于50%,即CO与N2;也可以是三种气体的混合物;
不可能出现SO2与N2、SO2与CO的组合.
故选D.
点评:推测混合物的组成.可采用平均值法,找出最小量为M1,最大量为M2,则其平均值一定在M1与M2之间.
解答:解:因为 SO2中氧元素的质量分数=
 ×100%=50%;CO中氧元素的质量分数=
×100%=50%;CO中氧元素的质量分数=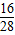 ×100%=57%;N2中氧元素的质量分数为0.
×100%=57%;N2中氧元素的质量分数为0.题中50%为混合气体中氧元素质量分数的平均值;
所以该气体可能为:可能是SO2;也可以一种大于50%一种小于50%,即CO与N2;也可以是三种气体的混合物;
不可能出现SO2与N2、SO2与CO的组合.
故选D.
点评:推测混合物的组成.可采用平均值法,找出最小量为M1,最大量为M2,则其平均值一定在M1与M2之间.

练习册系列答案
 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案
相关题目
(2004?宿迁)钛(Ti)因为具有许多神奇的性能而越来越引起人们的关注.某化学兴趣小组对Mg、Ti、Ag的金属活动性顺序进行探究.提出假设:a.Ti的金属活动性比Mg强;b.Ti的金属活动性介于Mg和Ag之间.
查阅资料:在相同条件下,金属与酸反应,产生气泡的速度越快,则该金属活动性越强.
实验设计:同温下,取大小相同的这三种金属薄片,分别投入等体积、等质量分数的足量稀盐酸中,观察现象.
请回答:
(1)三种金属加入盐酸前都先用砂纸将表面擦光亮,其目的是______(填序号)
①除去氧化膜,利于直接反应②使反应的金属温度相同,易反应 ③使表面光亮,易观察现象
(2)根据下表中的实验现象填空:
结论:原假设中______不正确(填“a”或“b”或“ab”),理由是______;三种金属的活动性由强到弱的顺序为______.
(3)上述实验设计中,如果所用盐酸的溶质质量分数不同,是否一定能够得出正确的结论?______(填“是”或“否”),理由是______.
查阅资料:在相同条件下,金属与酸反应,产生气泡的速度越快,则该金属活动性越强.
实验设计:同温下,取大小相同的这三种金属薄片,分别投入等体积、等质量分数的足量稀盐酸中,观察现象.
请回答:
(1)三种金属加入盐酸前都先用砂纸将表面擦光亮,其目的是______(填序号)
①除去氧化膜,利于直接反应②使反应的金属温度相同,易反应 ③使表面光亮,易观察现象
(2)根据下表中的实验现象填空:
| Ti | Mg | Ag | |
| 实验现象 | 产生气泡速度缓慢 | 产生气泡速度快 | 无任何现象 |
(3)上述实验设计中,如果所用盐酸的溶质质量分数不同,是否一定能够得出正确的结论?______(填“是”或“否”),理由是______.