题目内容
【题目】化学与生活、生产息息相关,请用所学化学知识回答。
(1) H、C、O、Ca、Cl是初中常见的几种元素,请选用其中的元素写出符合下列要求的物质的化学式:

① 人体胃液中含有的酸是 ;
② 用作补钙剂的盐是 ;
③ 煤炉中产生蓝色火焰的物质是 ;
④ 最简单的有机化合物是 。
(2)构建模型和构建知识网络是化学学习中重要的学习方法,某同学利用左手构建酸的性质知识网络(如图所示),请结合图示回答下列问题:
①酸溶液具有相似的化学性质是因为都含有 微粒(填符号)。
②图中①的现象是 。
③如用湿润的pH试纸测定盐酸的pH,则结果会 (填“偏大”、“偏小”或“无影响”)。
④氢氧化铝可用于治疗胃酸过多,写出反应的化学方程式 ,该反应属于 (填基本反应类型)反应。
【答案】(1)①HCl ②CaCO3 ③CO ④CH4(2)①H+ ②石蕊溶液变红 ③偏大 ④Al(OH)3+3HCl=AlCl3+3H2O 复分解
【解析】
试题分析:人体胃液中含有的酸是盐酸; 用作补钙剂的盐是碳酸钙;煤炉中产生蓝色火焰的物质是一氧化碳;最简单的有机化合物是甲烷。酸溶液具有相似的化学性质是因为都含有氢离子。图中①的现象是 石蕊溶液变红。如用湿润的pH试纸测定盐酸的pH,则结果会偏大,因为酸的PH值越大,酸性越弱。氢氧化铝可用于治疗胃酸过多,反应的化学方程式Al(OH)3+3HCl=AlCl3+3H2O,该反应属于复分解反应。

【题目】白云石粉是一种生产高级玻璃器皿、医药用瓶、光学玻璃的原料,某化学兴趣小组对白云石粉极其好奇,决定对其进行探究。
【查阅资料】白云石属于碳酸盐矿物,白云石粉主要成分的化学式可表示为:xMgCO3 · yCaCO3。( 杂质是二氧化硅,其不溶于水,也不与盐酸反应,受热不分解)
一、定性探究:白云石粉的成分和性质
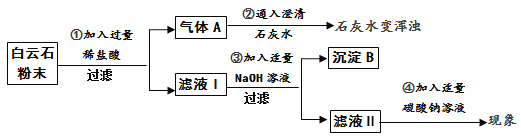
【实验分析】
(1)过滤操作中用到的玻璃仪器有玻璃棒、烧杯、 。
(2)由步骤①②的现象可得出白云石粉中一定含有的离子是 (填离子符号)。
(3)步骤③生成氢氧化镁的化学方程式是 。步骤④的反应现象是 。
【结 论】综合上述实验现象可初步证明白云石由碳酸钙、碳酸镁组成。
【实验质疑】小组同学经过讨论认为:因氢氧化钙微溶于水,导致沉淀B中除了氢氧化镁之外应该还混有氢氧化钙,对定量测定白云石粉的组成干扰较大,在老师的指导下该兴趣小组采用热分解法进行定量探究。
二、定量探究:白云石的组成
【查阅资料】碳酸钙开始分解的温度为898℃,1000℃时完全分解生成生石灰和二氧化碳气体;碳酸钙与碳酸镁的化学性质相似;碳酸镁开始分解的温度为540℃,700℃时完全分解。
【实验设计】为测定白云石中的含钙量及x:y的值,该兴趣小组设计了如下装置并进行实验:

【实验步骤】①组装仪器,检查装置的气密性;②准确称取15.0g 白云石粉末放在A装置中,打开弹簧夹,鼓入一段时间氮气,称量B、C、D装置的质量;③关闭弹簧夹,打开控温电加热器,缓缓调升温度至700℃,持续加热至固体质量不变;④打开弹簧夹,缓缓鼓入一段时间氮气,准确称量B、C、D装置的质量;⑤关闭弹簧夹,调升温度至1000℃,持续加热至固体质量不变,打开弹簧夹,缓缓鼓入一段时间氮气,准确称量B、C、D装置的质量。
实验数据记录如下表:
B中溶液质量/g | C中溶液质量/g | D中溶液质量/g | |
反应前 | 50.0 | 100.0 | 50.0 |
700℃ | 50.0 | 102.1 | 50.1 |
1000℃ | 50.0 | 106.3 | 50.3 |
【实验分析和数据处理】
(4)装置D的作用是 ;
(5)持续加热至固体质量不变后缓缓鼓入一段时间氮气的目的是 。
(6)计算白云石中钙元素的质量分数。(写出计算过程,结果保留小数点后一位):、
(7)设计实验证明白云石粉已完全分解的实验方法是 (写出实验方法、现象、结论)
(8)白云石(xMgCO3 · yCaCO3)中的 x:y= (最简整数比),若加热前没有鼓入一段时间的氮气,将会导致x:y的值 (填偏大、偏小或不变)。
