题目内容
【题目】在各种金属材料中铜是人类应用比较广泛的金属之一,某学习小组欲测定铜的相对原子质量,设计如下实验方案:
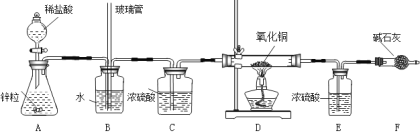
实验步骤:①连接好装置② ③装入药品④打开分液漏斗活塞向锥形瓶中滴入稀盐酸⑤一段时间后点燃酒精灯⑥D中黑色固体完全变成红色,停止加热,待D中玻璃管冷却至室温,关闭分液漏斗活塞⑦数据处理
请回答下列问题:
(1)请补全实验步骤② 。
(2)B装置中水的作用 ,长玻璃管的作用 ,
C装置的作用 ,D装置中反应的化学方程式 。
(3)已知:CuO样品质量为m1 g,E中增重为m2 g,D中反应后固体质量为m3 g,实际参加反应氢气的质量为m4 g,试用m1,m2列出铜的相对原子质量的表达式 。若无F装置,则对测定结果的影响 (填“偏大”、“偏小”、“无影响”),以下数据还能测定铜的相对原子质量的是 。
A. m2 m3 B. m3 m4 C. m1 m4 D. m2 m4
(4)请你评价实验有什么不妥之处 。
【答案】(1)检查装置气密性(2)吸收盐酸挥发出的HCl气体, 起安全作用,当B中压强过大时, B瓶中的水会压入长玻璃管,干燥氢气, H2+CuO![]() Cu+H2O(3)(18m1/m2)-16, 偏小, ABC(4)无法判断CuO是否完全反应
Cu+H2O(3)(18m1/m2)-16, 偏小, ABC(4)无法判断CuO是否完全反应
【解析】
试题分析:(1)根据实验要求可知,实验步骤②为检验装置的气密性;(2)B装置中水的作用吸收盐酸挥发出的HCl气体,长玻璃管的作用为起安全作用,当B中压强过大时, B瓶中的水会压入长玻璃管;C装置的作用干燥氢气;D装置中反应的化学方程式 H2+CuO![]() Cu+H2O;(3)设金属铜的相对原子质量为X
Cu+H2O;(3)设金属铜的相对原子质量为X
H2+CuO![]() Cu+H2O
Cu+H2O
X+16 18
m1 m2
X=(18m1/m2)-16
若无F装置,浓硫酸吸收空气中的水分,m2增大,故对测定结果将减小;根据设及的化学方程式可知,还能计算金属铜的相对原子质量的数据为ABC;(4)该装置存在无法判断氧化铜是否完全反应的弊端。

【题目】铁的锈浊对社会生产造成较大损害,但也有有利的一面,如某些食品包装袋内常放入还原性铁粉作“双吸剂”以防止食品腐败.某课外兴趣小组在实验室发现了一包破损的还原性铁粉(含少量杂质,杂质既不溶于水也不溶于酸),他们取六份样品,分别加稀硫酸反应.测得部分数据加下,请根据有关信息冋答问题.
实验次数 | 1 | 3 | 4 | 5 | 6 |
取样品质量(g) | 31.0 | 31.0 | 31.0 | 31.0 | 31.0 |
取稀硫酸质量(g) | 30.0 | 90.0 | 120.0 | 150.0 | 180.0 |
产生气体质量(g) | 0 | a | 0.3 | 0.5 | 0.6 |
(1)食品袋内放入“双吸剂”是为了吸收 ,用铁粉而不用铁块作“双吸剂”的理由是 .
(2)a的数值为 .
(3)第4次实验,所得到溶液中溶质的化学式为 .
(4)列式计算该样品中单质铁的质量分数(保留至0.1%).