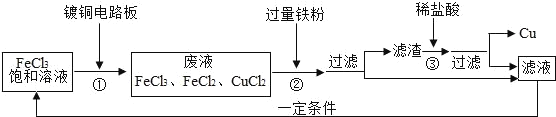
��Ŀ����
����Ŀ������˵������ȷ�ĸ����У�������
�ٵ�������O2��O3������ԭ����Ŀ��ͬ
�ڷ���Һ̬�����ķ�����ȡ���������˷ֽⷴӦ
����Ϊ![]() ��
��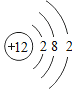 ������������ͬ���������Ǿ������ƵĻ�ѧ����
������������ͬ���������Ǿ������ƵĻ�ѧ����
�����������Ļ�ѧʽΪFe��NO3��3
����������֧��ȼ�գ������������ȼ��
����ͬ��Ԫ����ɵ�����һ���ǵ��ʣ��������ǻ�����
��NH4NO3�е�Ԫ�صĻ��ϼ�Ϊ+1��
A.1��B.2��C.3��D.4��
���𰸡�A
��������
�ٵ�������O2��O3������Ԫ�ص���ȣ���ԭ�ӵ�������ͬ������ԭ����Ŀ��ͬ����˵����ȷ��
�ڷ���Һ̬�����ķ�����ȡ�����Ĺ�����û�����������ʣ����������������仯����˵������
��![]() �Ļ�ѧ�����ȶ���
�Ļ�ѧ�����ȶ���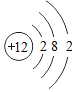 �ڻ�ѧ��Ӧ����ʧȥ������2�����ӣ���Ȼ���ߵ�������������ͬ���������ǵĻ�ѧ���ʲ����ƣ���˵������
�ڻ�ѧ��Ӧ����ʧȥ������2�����ӣ���Ȼ���ߵ�������������ͬ���������ǵĻ�ѧ���ʲ����ƣ���˵������
�����������У���Ԫ����+2�ۣ�������ԩ�1�ۣ��������Ļ�ѧʽΪFe��NO3��2����˵������
����������֧��ȼ�գ�û�п�ȼ�ԣ������������ȼ�ϣ���˵������
����ͬ��Ԫ����ɵ����ʲ�һ���ǵ��ʣ��������ͳ�����ɵĻ�����壬�����Ԫ��ֻ����Ԫ��һ�֣�������Ϊ����������ɵĻ�����˵������
��NH4NO3�е�Ԫ�صĻ��ϼ۷ֱ�Ϊ��3�ۡ�+5�ۣ���˵������
��ѡA��

 �������Ӧ���⼯ѵϵ�д�
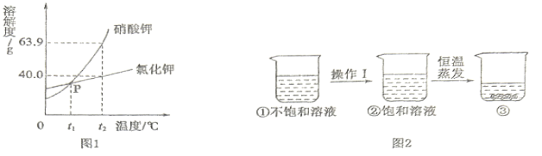
�������Ӧ���⼯ѵϵ�д�����Ŀ���ҹ��Ƽҵ������������°�ɹ�̽���Ľ����Ƽ�����±�Ϊ�������ʵ��ܽ�ȡ�
�¶�/��C | 10 | 20 | 30 | 40 | |
�ܽ��/g | Na2CO3 | 12.2 | 21.8 | 39.7 | 48.8 |
NaCl | 35.8 | 36.0 | 36.3 | 36.6 | |
NaHCO3 | 8.2 | 9.6 | 11.1 | 12.7 | |
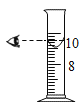
��1��10��C ~40��C,�ܽ�����¶ȱ仯��С������Ϊ_____�������ƣ���
��2���������������ֱ������ʵı�����Һ��40��C������20��C,������Һ�����ʵ����������ɴ�С��˳����_____________���û�ѧʽ��ʾ����
��3���Ƽ�ԭ��:��NaCl��Һ��ͨ������NH3��CO2����NaHCO3�����NH4Cl,NaHCO3���ȷֽ��Ƶô��
I .����NaHCO3�Ļ�ѧ����ʽΪ___��
II .����ϱ���NaHCO3����ᾧ������ԭ�������___������ĸ��ţ���
A ͬ����NaHCO3�ܽ��С��NaCl
B �ܼ���������
C ���ɵ�NaHCO3�����������ĵ�NaCl����