题目内容
【题目】某化学兴趣小组研究一包久置的双吸剂的组成,初步研究得知其一定含有Fe、CaCO3和CaO或Ca(OH)2。可能含有Fe2O3。为进一步确定组成,他们取3g样品研碎,用磁铁充分吸引,得到剩余固体2.6g,按照下图流程进行定量实验:
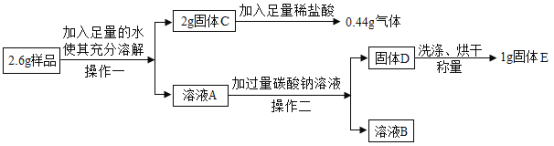
(1)操作一、操作二都相同,该操作是______,使用玻璃棒是为了防止_____。
(2)溶液A中加入碳酸钠溶液发生的反应方程式为_____,判断加入的碳酸钠溶液是否过量的方法____。
(3)确定固体E是否洗涤干净的方法是_____。
(4)经计算固体C的质量,得出______(填“是”或“否”)含有Fe2O3。
【答案】过滤 液体溅出 ![]() 取上清液,继续滴加碳酸钠溶液,若无沉淀生成,则碳酸钠溶液过量 取最后一次洗涤液,加BaCl2或CaCl2或稀盐酸或无色酚酞试液等,如无现象,则已洗净 是
取上清液,继续滴加碳酸钠溶液,若无沉淀生成,则碳酸钠溶液过量 取最后一次洗涤液,加BaCl2或CaCl2或稀盐酸或无色酚酞试液等,如无现象,则已洗净 是
【解析】
(1)操作一、操作二都相同,都是进行固液分离,该操作是过滤,使用玻璃棒是为了防止液体溅出。
(2)样品 Fe、CaCO3和CaO或Ca(OH)2,可能含有Fe2O3,加入足量的水溶解得到溶液A,溶液A为氢氧化钙溶液,加入碳酸钠溶液,反应生成碳酸钙沉淀和氢氧化钠,发生的反应方程式为![]() ,判断加入的碳酸钠溶液是否过量的方法:取上清液,继续滴加碳酸钠溶液,若无沉淀生成,则碳酸钠溶液过量。
,判断加入的碳酸钠溶液是否过量的方法:取上清液,继续滴加碳酸钠溶液,若无沉淀生成,则碳酸钠溶液过量。
(3)确定固体E是否洗涤干净的方法是:取最后一次洗涤液,加BaCl2或CaCl2或稀盐酸或无色酚酞试液等,如无现象,则已洗净。
(4)由题意可知,固体C为碳酸钙或碳酸钙和氧化铁的混合物,固体C与足量稀盐酸反应生成4.4g气体(碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳),设产生4.4g二氧化碳,需要碳酸钙的质量为x,则
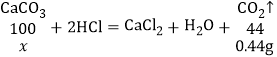
![]()
解得x=1g,而固体C为2g,故样品中含有Fe2O3。