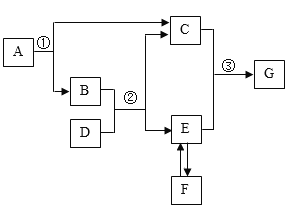
��Ŀ����
����Ŀ���������ɶ��ֳɷ���ɵĻ���������������̼������ĺ�������һ�ֶ�̬��ƽ�⡣
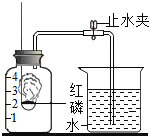
��1��ʵ���Ҳ�����ͼװ�òⶨ�����������ĺ�����ijͬѧ���ø�װ�ü���ԭ�����ⶨ�������ſ������ռ���һƿ�������ȣ���ͬѧȡ�����ĺ��ף���ȡ��������Ŀ����____����ʵ��ʱ���۲쵽������������ȼ�ձ��ڿ�����ȼ�յø��Ӿ��ң�˵��ȼ�յþ��ҳ̶���_____�йأ�ȼ��ʱ����������_____����������ȴ�����º�ֹˮ�з��ֽ��뼯��ƿ��ˮ��Լռ����ƿ�ݻ�������֮�壬ʣ�������֮һ������Ҫ��_____���ѧʽ����˵�������ſ������ռ������岻�����������Ҫ�ռ����Ƚϴ���������������_____�ռ���
��2����װʯ��ˮ���ձ��ڱڳ�����һ���ɫ�������ʣ��ð�ɫ�������ʵĻ�ѧʽΪ_____���γ�����ԭ���ǣ������ֱ���ʽ��ʾ��_____�����Ҫϴȥ�ð�ɫ�������ʣ������ã��ѧ���ƣ�_____ϴ�ӣ�ϴ��ʱ������Ӧ�����ֱ���ʽΪ_____��
����ˮ���������ܸ��ۡ��κ����ʶ������������ԣ�������̼�����к�������ᵼ������ЧӦ����������̼��;�ܶ࣬��д��������̼����;_____������дһ������
���𰸡���ȫ����ƿ������ ������Ũ���й� ���� N2 ��ˮ�� CaCO3 ������̼+�������ơ�̼���+ˮ ϡ���� ̼���+������Ȼ���+ˮ+������̼ ������������������õ�ԭ�ϵ�
��������
��1��ijͬѧ���ø�װ�ü���ԭ�����ⶨ�������ſ������ռ���һƿ�������ȣ���ͬѧȡ�����ĺ��ף�ȡ��������Ŀ���Ǻľ�ƿ��������������������ȼ�ձ��ڿ�����ȼ�յø��Ӿ��ң�˵��ȼ�յþ��ҳ̶���������Ũ���йأ�����ȼ�ղ����������̣�����ȴ�����º�ֹˮ�У����ֽ��뼯��ƿ��ˮ��Լռ����ƿ�ݻ�������֮�壬ʣ�������֮һ������Ҫ��N2��������������ˮ�����Ҫ�ռ����Ƚϴ�����������������ˮ����
��2���� ����ʯ��ˮ�����ڿ����У����������̼��Ӧ����̼��Ƴ�����ˮ����Ӧ�����ֱ���ʽΪ��������̼+�������ơ�̼���+ˮ��̼�������ϡ���ᷴӦ����������ˮ���Ȼ��ƣ��ʸð�ɫ���������ϡ��������ϴȥ��ϴ��ʱ������Ӧ�����ֱ���ʽΪ��̼���+������Ȼ���+ˮ+������̼���� ������̼��������������������������õ�ԭ�ϵȡ�

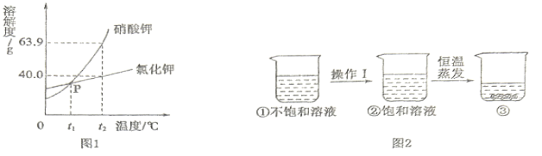
����Ŀ����1�����������������������Ȼ��Դ�������к��е�����������ϡ������ȣ���һ��_____������������������ʱ�̶��벻������������Ϊ�����е�������_____��
��2����A��B��C��D�������ʣ�A����ɫ����ζ�����壬B��A�п��Ծ���ȼ�գ���������������ɫ���棬�������д̼�����ζ������C����ȼ�յ�ľ��������ɫ��ζ��D�У�ľ��Ϩ����D�мӳ���ʯ��ˮ����ʯ��ˮ����ǡ�
�ɴ˿����ƶϣ�
�� A��_____��B��_____��C��_____��D��_____������д���ʵ����ƣ�
�� д��B��A��ȼ�յĻ�ѧ����ʽ��_____��
��3�����п�����������������̼������ɫ���壬���������ѡ�������壬����һ�ֵķ����������ǡ���ѡ�������������_____��_____��������_____
��4��ij��ѧ��ȤС���ͬѧ���������ϵ�֪���˺����и��������������������ʾ��
���� | �������� | �������� |
X | 78% | 75% |
Y | 21% | 15% |
������̼ | 0.03% | 3.68% |
ˮ | 0.02% | 5.44% |
���� | 0.95% | 0.88% |
�� �����жϣ�����X��_____��Y��_____��
�� ��֤�������Ĵ��ڣ���ʵ�鷽����_____��
����Ŀ��Ϊ̽��ij���ϵ����Ԫ�أ������ʵ�� I �� II���ش��������⣺
I����ȡ����
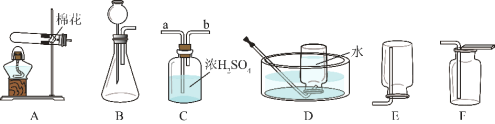
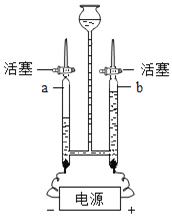
��1������һ�ְ���ɫ������ȡ O2��������Ӧ�Ļ�ѧ����ʽΪ_____������װ��Ӧѡ������װ��_____�����ţ���
��2������ȡ����� O2��װ�ú���������˳��Ϊ������װ����C��_____�����ţ�������װ��ʱ������װ�õij�����Ӧ��װ�� C ��_____������a������b������������
II�����̽��
��3�����Լ�⣨��֪����ˮ CuSO4 ��ˮ����ɫ��
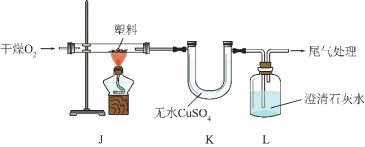
ʵ����� | ʵ������ | ���� |
����װ�ã���������ԣ�װ���Լ�������ͼ����ʵ�顣ͨ�� O2��һ��ʱ���ȼ J ���ƾ��ơ� | װ�� K ����ˮ CuSO4���_____ɫ | ����ȼ�ղ������� H2O |
װ�� L �Т�_____ | ����ȼ�ղ������� CO2 |
��������ʵ���֪��������һ�����е�Ԫ����_____����Ԫ�ط��ţ���
��4�������ⶨ
Ϊ��һ��ȷ����ɣ��� 1.4g ������������ O2 ����ȫȼ�գ��������� 4.4g CO2 �� 1.8g H2O�����������غ㶨�ɣ����жϸ�����_____���������������������������������н���֮���Ԫ�ء�