题目内容
实验室有一瓶存放时间较长的氢氧化钠,其中的一部分已 转化成了碳酸钠。取50.6 g该药品溶于200 g水(水的密度为l g/mL)中,慢慢滴入17. 1%的氢氧化钡溶液,当用去100 g氢氧化钡溶液时,碳酸钠恰好完全反应。试求:
(1)50.6 g药品中碳酸钠的质量。
(2)滤出沉淀后的溶液中溶质质量和溶液质量。
(3)把所得溶液蒸发多少毫升才能制成20%的氢氧化钠溶液?
(1)50.6 g药品中碳酸钠的质量。
(2)滤出沉淀后的溶液中溶质质量和溶液质量。
(3)把所得溶液蒸发多少毫升才能制成20%的氢氧化钠溶液?
解:(1)设含有Na2CO3的质量为x,生成BaCO3的质量为y,生成NaOH的质量为z。
Na2CO3 +Ba(OH)2 === BaCO3 ↓+2NaOH
106 171 197 80
x 100 g ×17.1% y z
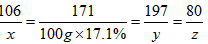
x=10.6 g,y=19.7 g,z=8 g。
(2)滤出沉淀后溶质质量为: 50.6 +17.1 - 19.7=48(g). 溶液质量为:50.6 g+200 g+100 g-19.7 g=330.9 g。
(3)设需要蒸发掉水的质量为x。 (330.9 g -x) ×20% =48 g x =90.9 g。
Na2CO3 +Ba(OH)2 === BaCO3 ↓+2NaOH
106 171 197 80
x 100 g ×17.1% y z
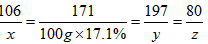
x=10.6 g,y=19.7 g,z=8 g。
(2)滤出沉淀后溶质质量为: 50.6 +17.1 - 19.7=48(g). 溶液质量为:50.6 g+200 g+100 g-19.7 g=330.9 g。
(3)设需要蒸发掉水的质量为x。 (330.9 g -x) ×20% =48 g x =90.9 g。

练习册系列答案
 快捷英语周周练系列答案
快捷英语周周练系列答案
相关题目