题目内容
(2011?南宁)在金属活动性顺序表里,金属的位置越靠前,它的活动性就越强,在化学反应中越容易失去电子.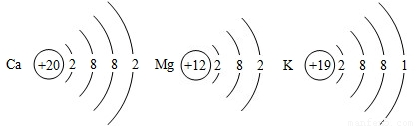
(1)Ca、Mg、K三种金属在化学反应中失去电子的能力由强到弱的顺序是______.
(2)Ca、Mg、K三种金属的原子结构示意图如右图所示,请根据这三种金属的原子结构示意图,结合已学过的有关原子结构的知识推测:金属单质失去电子能力的强弱主要与哪些因素有关?______(任答两点).
(3)能证明Cu的金属活动性比Ag强的方法是:______(用化学方程式表示).
(4)非金属单质也具有类似金属与盐溶液之间的置换反应规律,即活动性较强的非金属可把活动性较弱的非金属从其盐溶液中置换出来.例如,在溶液中可发生以下反应:Cl2+2NaBr=2NaCl+Br2; Br2+2KI=2KBr+I2↓;I2+Na2S=2NaI+S 由此可以判断硫(S)、溴( Br2)、碘(I2)、氯气(Cl2)四种非金属单质的活动性由弱到强的顺序的是______.
【答案】分析:(1)由在金属活动性顺序表里,金属的位置越靠前,它的活动性就越强,在化学反应中越容易失去电子,可以进行分析判断.
(2)决定元素化学性质的是最外层电子数,原子的电子层数越多,在最外层电子数一定的条件下,就越容易失去电子,据此分析.
(3)前面的金属可以把排在它后面的金属从盐溶液中置换出来,根据这一规律可以判断反应是否发生及金属的活动性强弱.
(4)由信息:活动性较强的非金属可把活动性较弱的非金属从其盐溶液中置换出来,分析解答.
解答:解:(1)Ca、Mg、K三种金属活动性强弱顺序为K>Ca>Mg,故根据题目所给信息可知,在化学反应中失去电子的能力由强到弱的顺序是K>Ca>Mg.
(2)决定元素化学性质的是最外层电子数,原子的电子层数越多,在最外层电子数一定的条件下,就越容易失去电子,故金属单质失去电子能力的强弱主要与最外层电子数、电子层数有关.
(3)由于铜的化学性质比银活泼,因此可以选择铜和硝酸银溶液反应来证明铜比银活泼.
(4)非金属单质也具有类似的置换反应规律,即活动性较强的非金属可把活动性较弱的非金属从其盐溶液中置换出来,由反应C12+2NaBr=2NaCl+Br2可得非金属性C12>Br2,同理可得I2>S,Br2>I2,故选C12>Br2>I2>S.即四种非金属单质的活动性由弱到强的顺序的S<12<Br2<C12.
故答案为:(l)K>Ca>Mg;
(2)最外层电子数; 电子层数;
(3)Cu+2AgN03=Cu(N03)2+2Ag;
(4)S<12<Br2<C12(或硫<碘<溴<氯气).
点评:本题难度中等,注重了和课本所学知识的联系,做到知识的迁移应用,检验学生活学活用的学习能力.
(2)决定元素化学性质的是最外层电子数,原子的电子层数越多,在最外层电子数一定的条件下,就越容易失去电子,据此分析.
(3)前面的金属可以把排在它后面的金属从盐溶液中置换出来,根据这一规律可以判断反应是否发生及金属的活动性强弱.
(4)由信息:活动性较强的非金属可把活动性较弱的非金属从其盐溶液中置换出来,分析解答.
解答:解:(1)Ca、Mg、K三种金属活动性强弱顺序为K>Ca>Mg,故根据题目所给信息可知,在化学反应中失去电子的能力由强到弱的顺序是K>Ca>Mg.
(2)决定元素化学性质的是最外层电子数,原子的电子层数越多,在最外层电子数一定的条件下,就越容易失去电子,故金属单质失去电子能力的强弱主要与最外层电子数、电子层数有关.
(3)由于铜的化学性质比银活泼,因此可以选择铜和硝酸银溶液反应来证明铜比银活泼.
(4)非金属单质也具有类似的置换反应规律,即活动性较强的非金属可把活动性较弱的非金属从其盐溶液中置换出来,由反应C12+2NaBr=2NaCl+Br2可得非金属性C12>Br2,同理可得I2>S,Br2>I2,故选C12>Br2>I2>S.即四种非金属单质的活动性由弱到强的顺序的S<12<Br2<C12.
故答案为:(l)K>Ca>Mg;
(2)最外层电子数; 电子层数;
(3)Cu+2AgN03=Cu(N03)2+2Ag;
(4)S<12<Br2<C12(或硫<碘<溴<氯气).
点评:本题难度中等,注重了和课本所学知识的联系,做到知识的迁移应用,检验学生活学活用的学习能力.

练习册系列答案
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案
相关题目