题目内容
【题目】某同学对三种牙膏的成分和性质进行如下探究。
①测定牙膏的pH。
甲:pH=8.5 乙:pH=7.0 丙:pH=6.5能缓解牙齿酸痛的碱性牙膏是( 33)(填“甲”、“乙”、“丙”)。
②检验牙膏中是否含有碳酸钙。
该同学用检验碳酸盐的方法检验牙膏中是否含有碳酸钙,实验记录如下。
实验步骤 | 实验现象 | 实验结论 |
各取三种牙膏膏体于试管中,加入适量稀盐酸。 | 甲、乙牙膏的表面( 34);丙牙膏的表面无明显现象。 | 甲、乙牙膏中含碳酸钙,丙牙膏中不含碳酸钙。 |
上述实验不够完善,还需增加的一步操作是( 35) 。
③比较甲、乙牙膏中碳酸钙的质量分数。
【实验原理】通过测定逸出气体的质量,可计算出碳酸钙的质量分数(牙膏中其它物质不与盐酸反应)。
【实验步骤】按下图装置进行实验,记录不同时刻装置和药品的总质量,数据如下:
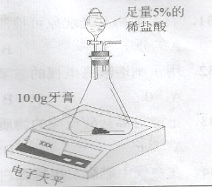
时间(min) | 0 | 2 | 4 | 6 | 8 | 10 | 12 | |
装置和药品总质量(g) | 牙膏甲 | 261.0 | 260.0 | 259.3 | 258.8 | 258.5[ | 258.5 | 258.5 |
牙膏乙 | 263.0 | 262.4 | 261.9 | 261.4 | 261.0 | 261.0 | 261.0 | |
【实验结论】( 36);
【实验反思】经查实,上述方法所测得的两种牙膏的碳酸钙含量均偏小(实验操作规范),导致偏小的原因可能是( 37) 。
A.盐酸挥发 B.有水蒸气逸出
C.装置漏气 D.锥形瓶内残留二氧化碳
【答案】(33)甲;
(34)有气泡冒出;
(35)将生成的气体通入澄清石灰水观察是否变浑浊;
(36)甲牙膏中所含碳酸钙的质量分数大于乙;
(37)D
【解析】
试题分析:①根据酸碱中和反应原理可知,能缓解牙齿酸痛的碱性牙膏是甲,因为碱性溶液的pH大于7;②检验牙膏中是否含有碳酸钙。根据碳酸钙的性质能与稀盐酸反应生成二氧化碳气体,故观察到有气泡冒出,未验证是二氧化碳必须将生成的气体通入澄清石灰水观察是否变浑浊;③比较甲、乙牙膏中碳酸钙的质量分数。根据反应前后质量的改变,减小的质量就为生成的二氧化碳的质量,二氧化碳的多少与碳酸钙的含量成正比例关系,故【实验结论】甲牙膏中所含碳酸钙的质量分数大于乙;【实验反思】经查实,上述方法所测得的两种牙膏的碳酸钙含量均偏小(实验操作规范),导致偏小的原因可能是D.锥形瓶内残留二氧化碳。

 春雨教育同步作文系列答案
春雨教育同步作文系列答案