题目内容
【题目】下图中的 A~I 表示几种初中化学常见的物质,分别是由 H、C、N、O、Na、Al、S、Cl、Ca、Cu、Ag、Ba 中的一种或几种元素组成的。在通常情况下,A 与其他物质的状 态不同;A、D 为单质;D 具有良好的抗腐蚀性;C 可用来改良酸性土壤;E 的溶液呈蓝色;H 由两种元素组成;I 俗名纯碱。图中“—”表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系;部分反应物、生成物或反应条件已略去。

(1)写出化学式:D_____,I_____。
(2)写出 B→A 反应的化学方程式_____。
(3)写出 C→F 反应的化学方程式_____。
(4)反应①和②所属基本反应类型相同,该反应类型是_____。
【答案】Al Na2CO3 Fe+H2SO4=FeSO4+H2↑ Ca(OH)2+Na2CO3=CaCO3↓+2NaOH 复分解反应
【解析】
(1)如图中的A-1表示几种初中化学常见的物质,分别是由H、C、N、O、Na、A1、S、Cl、Ca、Cu、Ag、Ba中的一种或几种元素组成的,在通常情况下,A与其他物质的状态不同,A、D为单质,所以A是氢气,D具有良好的抗腐蚀性,所以D是铝,C可用来改良酸性土壤,所以C是氢氧化钙,E的溶液呈蓝色,所以E是硫酸铜,H由两种元素组成,I俗名纯碱,所以I是纯碱,H会与碳酸钠反应,所以H是氯化钡,氢氧化钙转化成的F会转化成碳酸钠,所以F是氢氧化钠,B会转化成硫酸铜,所以B是硫酸,G会与氯化钡、铝反应,所以G是硝酸银,经过验证,推导正确,所以D是Al,I是Na2CO3;
(2)B→A的反应是硫酸和铁反应生成硫酸亚铁和氢气,化学方程式为:Fe+H2SO4=FeSO4+H2↑;
(3)C→F的反应是氢氧化钙和碳酸钠反应生成碳酸钙沉淀和氢氧化钠,化学方程式为:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH;
(4)①和②所属基本反应类型相同,该反应类型是复分解反应。
故答案为:(1)Al,Na2CO3;
(2)Fe+H2SO4=FeSO4+H2↑;
(3)Ca(OH)2+Na2CO3=CaCO3↓+2NaOH;
(4)复分解反应。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】“国庆”假期,小周对“活泼金属与硫酸溶液反应快慢的影响因素”进行了探究。
(提出问题)活泼金属与硫酸溶液反应的快慢受哪些因素的影响呢?
(猜想与假设)a.可能与硫酸溶液的质量分数有关;
b.可能与金属的形状有关;
c.可能与金属的种类有关。
(设计并实验)小周用不同质量分数的硫酸溶液和不同形状的锌进行如下实验:
实验编号 | 硫酸溶液的质量分数(均取20mL) | 锌的形状 (均取1g) | 氢气的体积(mL) (均收集3分钟) |
① | 5% | 锌粒 | 15.6 |
② | 5% | 锌片 | 25.9 |
③ | 10% | 锌粒 | 32.7 |
④ | 10% | 锌片 | 40.9 |
(1)小周用如图装置收集并测量氢气的体积,氢气应从_____管通入。(填e或f或g)
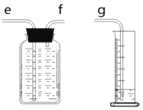
(2)(收集证据)要比较不同质量分数的硫酸溶液与锌反应快慢的影响,可以选择的实验编号是_____。
(得出结论)……
(反思与评价)你认为本实验设计存在哪些不足之处_____。