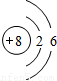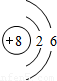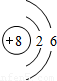题目内容
我国兰州的近代物理研究所曾经研究制出首批重氧气O2(其相对原子质量为18),其价格远远超过黄金.则下列说法正确的是( )A.重氧气的相对分子质量为32
B.重氧气中氧原子的结构示意图为
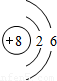
C.重氧气中氧元素的化合价为-2
D.重氧气(O2)是一种化合物
【答案】分析:根据重氧气的化学式O2(其相对原子质量为18),计算其相对分子质量、判断组成元素的化合价及物质分类、分析物质组成元素和原子结构示意图;
单质是由同种元素组成的纯净物,单质中组成元素的化合价为0;
化合物是由不同种元素组成的纯净物.
解答:解:A、重氧气的相对分子质量=18×2=36,而非32,所以该项说法不正确;
B、构成重氧气分子的原子为氧元素的原子,虽然相对原子质量为18,但该原子依旧是氧元素的一个原子,同种元素的质子数相同,所以构成重氧气分子的原子中质子数为8、核外电子分两层,第一层有2个电子,第二层有6个电子.因此该项说法正确;
C、重氧气是由同种元素组成的单质,单质中元素化合价为0,而非-2,所以该项说法不正确;
D、重氧气是只含O元素的纯净物,为单质而非化合物,所以该项说法不正确.
故选B
点评:构成重氧分子的原子是:质子数为8、中子数为10、核外电子数为8的一种氧元素的原子.
单质是由同种元素组成的纯净物,单质中组成元素的化合价为0;
化合物是由不同种元素组成的纯净物.
解答:解:A、重氧气的相对分子质量=18×2=36,而非32,所以该项说法不正确;
B、构成重氧气分子的原子为氧元素的原子,虽然相对原子质量为18,但该原子依旧是氧元素的一个原子,同种元素的质子数相同,所以构成重氧气分子的原子中质子数为8、核外电子分两层,第一层有2个电子,第二层有6个电子.因此该项说法正确;
C、重氧气是由同种元素组成的单质,单质中元素化合价为0,而非-2,所以该项说法不正确;
D、重氧气是只含O元素的纯净物,为单质而非化合物,所以该项说法不正确.
故选B
点评:构成重氧分子的原子是:质子数为8、中子数为10、核外电子数为8的一种氧元素的原子.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目