��Ŀ����
����Ŀ���ס������ֹ�����ˮ�е��ܽ��������ͼ1��ʾ����t3��ʱ��������ֻ��ʢ��100gˮ���ձ��зֱ����50g�ס��ң�����ܽ��۲쵽��������ͼ2��ʾ���ٽ���Һ�¶Ƚ���t1�棬�����ͼ3��ʾ����ͼ����ĸa��b��c��dΪ��Ӧ�ձ�����Һ�ı�ţ�
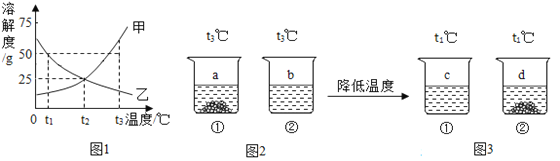
��1���ձ������ܽ���ǹ���______����������������������
��2��ͼ2��ͼ3�У��ձ��ڵ���Һһ��Ϊ��������Һ����_______�����ձ�����Һ�ı�ţ���
��3��t2�� ʱȡһ�����ı�����Һ��ˮϡ�ͳ�100g��������Ϊ5%�ļ���Һ�����ˮ��������_______��
��4������ͼ3���ձ��ڵ����ʣ�����˵����ȷ����________��
A �ձ�������Һ��������������һ��С���ձ�������Һ��������������
B �����ձ�����������һ������ˮ�������ձ���һ�����й�������
C �����������¶ȣ����ձ�����Һ����������������һ����С
D �����¶Ȳ��䣬���������ձ��е���Һ��ϲ���ֽ�����ձ�����ʣ������������� ���䣨���ʱû�л�ѧ��Ӧ������
���𰸡��� b 75g AB
��������
��1���¶���t3��ʱ����t1��ʱ���ձ�����δ�ܽ�Ĺ�������ܽ�ֱ����ȫ�ܽ⣬˵���ձ����й�����ܽ�����¶Ƚ��Ͷ������ͼ��֪���ù���Ϊ�ң������ҡ�
��2����ͼ��֪����Һa��dΪ������Һ����ҺbΪt3��ʱ����Һ���������ʼ�����Ϊ50g��ˮ������Ϊ100g��t3��ʱ���ܽ�ȴ���50g��������ҺbΪ��������Һ����Һc��t1��ʱ�ҵ���Һ�����������ҵ�����Ϊ50g��ˮ������Ϊ100g��t1��ʱ�ҵ��ܽ��Ϊ50g��������Һc���ҵı�����Һ������b��
��3��t2�� ʱ���ܽ��Ϊ25g����ı�����Һ��������������Ϊ![]() ��100%=20%�����ˮ������Ϊ100g
��100%=20%�����ˮ������Ϊ100g ![]() =75g������75g��
=75g������75g��
��4��A �ձ��٢��мס��ҵ�������Ϊ50g��ˮ������Ϊ100g���ձ������о��������������ձ�������Һ��������������һ��С���ձ�������Һ����������������ѡ����ȷ��
B �����ձ��е���Һ��Ϊ������Һ�����������ձ�����������һ������ˮ�������ձ���һ�����й���������ѡ����ȷ��
C �����������¶ȣ��ձ����е��ҵ��ܽ�ȱ����Һ�ɱ�����Һ��Ϊ��������Һ��û�о������������������������䣬�ձ��ڵ����ʼ��ܽ�����¶Ƚ��Ͷ���С����Һ�����ᾧ�������壬��Һ����������������С��ѡ�����
D ��Һc���ҵı�����Һ�������ܽ��ң������ܽ�ף����Ա����¶Ȳ��䣬���������ձ��е���Һ��ϲ���ֽ�������ձ�����ʣ�������ܽ⣬�������٣�ѡ�������AB��

 �������Ͽ��㱾ϵ�д�
�������Ͽ��㱾ϵ�д�����Ŀ������ʵ����Ʋ��ܴﵽĿ�ĵ��ǣ� ��
ѡ�� | A | B | C | D |
ʵ����� |
|
|
|
|
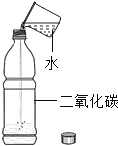
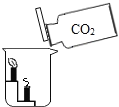
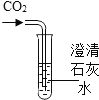
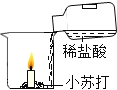
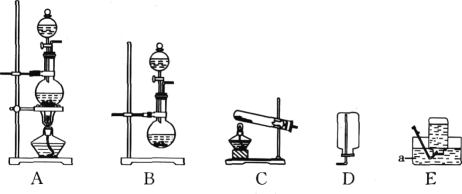
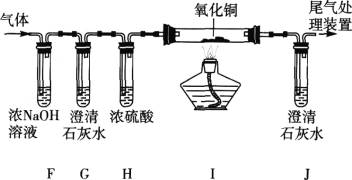
ʵ�� Ŀ�� | ֤��������̼������ˮ | ֤��������̼�ܶȴ��ڿ��� | ֤��ͨ������� �Ƕ�����̼ | ֤��С�մ�����ϡ���ᷴӦ�ų� CO2 |
A. AB. BC. CD. D