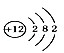题目内容
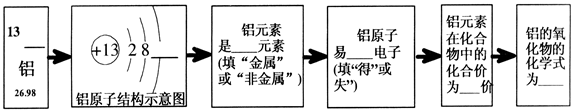
元素周期表是同学们学习化学的重要工具。请根据铝元素的“身份证”(见下图),在下图的横线上填写有关铝元素的6个信息。




 (1)历史上,道尔顿认为,原子是一个个简单的、不可分割的实心球体。现在你认为
(1)历史上,道尔顿认为,原子是一个个简单的、不可分割的实心球体。现在你认为
 该观点 (选填“正确”或“错误”)。(1分)
该观点 (选填“正确”或“错误”)。(1分)
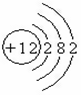
 (2)现代化学上,氧、镁两元素的原子结构示意图分别
(2)现代化学上,氧、镁两元素的原子结构示意图分别 如图所示:
如图所示: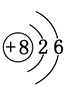

 下表是元素周期表的一部分(数字表示相应元素的原子序数),请用元素符号将两种元素填入表中相应位置。(2分)
下表是元素周期表的一部分(数字表示相应元素的原子序数),请用元素符号将两种元素填入表中相应位置。(2分)


| 1H | | 2He | |||||
| 3Li | 4Be | 5B | | | | 9F | 10Ne |
| 11Na | | | 14Si | | 16S | 17Cl | 18Ar |
 (3)上表氯元素的每个原子需要得到 个电子形成相对稳定结构的离子,该离子与镁离子形成化合物的化学式为 。(2分)
(3)上表氯元素的每个原子需要得到 个电子形成相对稳定结构的离子,该离子与镁离子形成化合物的化学式为 。(2分) (4)亚氯酸钠(NaClO2)是一种重要的消毒剂,其中氯元素的化合价为 。(1分
(4)亚氯酸钠(NaClO2)是一种重要的消毒剂,其中氯元素的化合价为 。(1分
Al;3;金属;失;+3;Al2O3(1)错误;
(2)1H 2He 3Li 4Be 5B 8O 9F 10Ne 11Na 12Mg 14Si 16S 17Cl 18Ar
(3)1; MgCl2; (4)+3
解析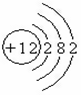
试题分析:由题中图可知13号元素铝的元素符号为Al,最外层有3个电子,属于金属元素,容易失去电子形成阳离子在化合物中的化合价为+3价,形成氧化物的化学式为Al2O3;由以上知识可知原子有内部结构所以 (1)历史上,道尔顿认为,原子是一个个简单的、不可分割的实心球体
(1)历史上,道尔顿认为,原子是一个个简单的、不可分割的实心球体 的观点是错误;
的观点是错误;
(2)由氧、镁两元素的原子结构示意图可知氧的原子序数为8,镁的原子序数为12,所以填入下表位置1H 2He 3Li 4Be 5B 8O 9F 10Ne 11Na 12Mg 14Si 16S 17Cl 18Ar
因为氯元素原子序数为17,最外层的电子数为7,容易得到1个电子形成相对稳定结构的离子,该离子与镁离子形成化合物的化学式为MgCl2;根据化学式中元素正负化合价的代数和为0可计算出
(4)亚氯酸钠(NaClO2)是一种重要的消毒剂,其中氯元素的化合价为:+1价。
考点:原子结构、元素周期表以及化学式的书写、化合价的判断

 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案元素周期表是化学学习和研究的重要工具。下图是元素周期表的一部分,根据表中信息回答下列问题。
| Ⅳ A | Ⅴ A | Ⅵ A | Ⅶ A |
| 6 C 碳 12.01 | 7 N 氮 14.01 | 8 O 氧 16.00 | 9 F 氟 19.00 |
| Si 硅 28.09 | 15 磷 30.97 | 16 S 硫 32.07 | 17 Cl 氯 35.45 |
(1)碳元素的原子序数是 ,相对原子质量是 。
(2)第15号元素的符号是 ,与15号元素化学性质相似的元素为 。
(3)利用元素周期表,人们对元素的认识进入了全新的飞跃时期。近日,俄罗斯科学家宣布他们将人工合成118号元素,则此元素的核电荷数为 。