题目内容
【题目】为测定某种贝壳中碳酸钙的含量,取25g贝壳,逐渐加入稀盐酸,充分反应后,测得剩余固体质量与加入稀盐酸的质量关系如图所示(已知杂质不参与反应,也不溶于水)请计算:
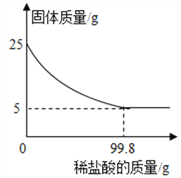
(1)这种贝壳中碳酸钙的质量分数是_______。
(2)25g贝壳与稀盐酸恰好完全反应时,所得溶液中溶质的质量分数为_____。
【答案】 80% 20%
【解析】(1)固体减少的质量是反应掉的碳酸钙的质量,即碳酸钙的质量为:25g-5g=20g,
贝壳中碳酸钙的质量分数是: ![]() ×100%=80%
×100%=80%
(2)设25g贝壳与稀盐酸恰好完全反应时,所得溶液中溶质的质量为x,生成二氧化碳的质量为y
CaCO3 + 2HCl == CaCl2 + H2O + CO2↑
100 111 44
20g x y
![]() =
=![]() ,解得x=22.2g
,解得x=22.2g
![]() =
=![]() ,解得y=8.8g
,解得y=8.8g
根据质量守恒定律,反应后溶液的质量为:20g+99.8g-8.8g=111g
反应后所得溶液中溶质的质量分数为: ![]() ×100%=20%
×100%=20%

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
【题目】下图是用氯化钠溶液和氯化钾溶液制取氯酸钾的工艺流程,请根据题意回答下列问题。
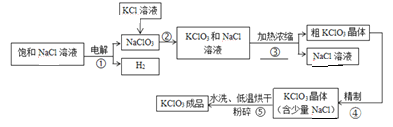
【资料】氯酸钾和氯化钠部分温度下的溶解度如下:
10℃ | 20℃ | 30℃ | 40℃ | |
氯酸钾 | 5.0g | 7.4g | 10.0g | 14.0g |
氯化钠 | 35.8g | 36.0g | 36.3g | 36.6g |
(1)请写出步骤②的化学方程式_________,该反应的基本反应类型是_________________。
(2)步骤③的操作分别是_________、过滤(填操作名称)。
(3)步骤⑤中是采用20℃以下的水进行洗涤,目的是①除去少量氯化钠②_____________。
(4)步骤⑤采用低温烘干,为什么不采用高温烘干___________________________(用化学方程式表示)。