题目内容
【题目】小强在回家的途中经过一鱼塘边时,发现养鱼师傅向鱼塘中撒一种微黄色的固体,鱼塘中顿时产生大量气泡,经咨询得知,这种固体的主要成分是过氧化钙(CaO2),请你与小强共同探究。
(1)为研究鱼塘中大量气泡是何种气体所致,小强使用如下图所示的装置进行实验,打开仪器a的活塞,控制滴加水的速度,观察到试管内有气泡产生,用带火星的木条靠近P处,木条复燃,说明生成的气体是。由此可知养鱼师傅向鱼塘中撒过氧化钙的目的是 , 仪器a的名称是。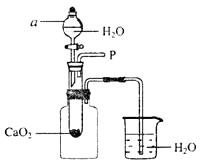
(2)根据质量守恒定律,小强认为过氧化钙与过量水反应还应产生某种含有钙元素的产物。开始小强假设该产物为CaO,但通过思考他很快否定了原先的假设,并重新假设生成的含钙产物为Ca(OH) 2。请解释小强否定原假设建立新假设的理由: 。
请设计一个实验方案来验证小强的新假设,并填入下表空格中:
实验步骤 | 可能出现的现象 | 结论 |
CaO2与H2O反应有Ca(OH) 2生成 | ||
CaO2与H2O反应无Ca(OH) 2 生成 |
(3)小强通过实验证明了过氧化钙与水反应的确有氢氧化钙生成,请写出过氧化钙和水反应的化学方程式: 。
(4)小强在实验时观察到烧杯中有气泡产生,由此他还得出了什么结论。
【答案】
(1)O2 ,补充鱼塘中的氧气,分液漏斗
(2)在水较多的环境中即使生成CaO,也会和水作用生成Ca(OH)2,取反应后所得的溶液样品滴入酚酞指示剂,变红
(3)2CaO2 + 2H2O = 2Ca(OH)2 + O2↑
(4)过氧化钙与水反应是放热反应
【解析】(1)能使带火星木条复燃的气体一定是氧气,氧气不易溶于水、可以维持呼吸,为使水中鱼持续获得氧气,需要不断向水中补充氧气.
(2)氧化钙极易与水反应生成氢氧化钙,因此,氧化钙不能在水中存在.
氢氧化钙溶于水溶液呈碱性,滴入酚酞试液会变成红色;向氢氧化钙溶液通入二氧化碳会出现浑浊.
(3)经过以上的探究,可得知过氧化钙与水反应会放出气体--氧气,同时生成氢氧化钙,过氧化钙和水反应的化学方程式:2CaO2+2H2O=2Ca(OH)2+O2↑;
(4)实验中与广口瓶相连的导管有气泡冒出,是由于广口瓶内气体受热膨胀,热量则来自于过氧化钙与水反应放出的热.
所以答案是:(1)O2 ;补充鱼塘中的氧气;分液漏斗;(2)在水较多的环境中即使生成CaO,也会和水作用生成Ca(OH)2;取反应后所得的溶液样品滴入酚酞指示剂;变红;(3)2CaO2 + 2H2O = 2Ca(OH)2 + O2↑;(4)过氧化钙与水反应是放热反应.
【考点精析】关于本题考查的氧气的检验和验满和质量守恒定律及其应用,需要了解氧气的验满:用带火星的木条放在集气瓶口;检验:用带火星的木条伸入集气瓶内;①质量守恒定律只适用于化学变化,不适用于物理变化;②不参加反应的物质质量及不是生成物的物质质量不能计入“总和”中;③要考虑空气中的物质是否参加反应或物质(如气体)有无遗漏才能得出正确答案.

【题目】KCl是一种常用的钾肥,其溶解度如下表。下列说法正确的是( )
温度/℃ | 0 | 20 | 40 | 60 |
溶解度/g | 27.6 | 34.0 | 40.0 | 45.5 |
A.KCl饱和溶液中不能再溶解其他物质
B.20℃时,100 g KCl饱和溶液中含KCl 34.0 g
C.40℃时,KCl饱和溶液的质量分数约为28.6%
D.60℃的KCl溶液降温至20℃,一定有晶体析出