题目内容
【题目】生活中常见物质的性质、制法的是化学研究的重要内容.
(1)复分解反应发生后,生成物肯定不会是(填“单质”或“化合物”).
(2)盐酸与氢氧化钠溶液反应时溶液pH的变化如图所示.下列说法正确的 . 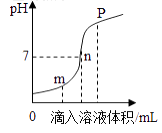
a.m点所示溶液为碱性
b.n点所示溶液中加紫色石蕊溶液呈红色
c.p点所示溶液中的溶质为NaCl和NaOH
d.该图所对应操作是将盐酸滴入氢氧化钠溶液中
(3)如图装置可作一氧化碳还原氧化铁的实验,并检验生成的气体产物.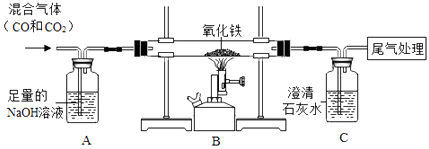
①B装置玻璃管里可观察到的现象为 .
②C装置中反应的化学方程式为 .
③工业上可利用“铝热反应”焊接钢轨、冶炼难熔金属等,其原理是在高温下用铝将这些金属从其氧化物中置换出来,若用铝与四氧化三铁反应来制取25.2kg铁,理论上需要消耗铝的质量是多少?
【答案】
(1)单质
(2)c
(3)红色固体变黑,CO2+Ca(OH)2=CaCO3↓+H2O,10.8kg
【解析】(1)复分解反应是两种化合物相互交换成分生成另外两种化合物的反应,故复分解反应发生后,生成物肯定不会是单质;
(2)a、m点所示溶液的pH<7,呈酸性,错误;b、n点所示溶液pH=7,呈中性,中性溶液不能使紫色石蕊变色,故仍呈紫色,错误;c、p点所示溶液的pH>7,说明溶液呈碱性,即加入的氢氧化钠溶液过量,那么溶液中的溶质有生成的氯化钠和过量的氢氧化钠两种,正确;d、由溶液pH的变化图可知,溶液的起始pH<7,故是将氢氧化钠滴入稀盐酸中,错误;故选c;
(3)①一氧化碳还原氧化铁生成铁和二氧化碳,故观察到的现象是红色固体逐渐变成黑色;②二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水,反应的化学方程式表示为:CO2+Ca(OH)2=CaCO3↓+H2O;③根据描述可知,在高温时,铝与四氧化三铁反应生成铁和氧化铝,利用化学方程式,根据铁和铝的质量比即可计算出消耗的铝的质量.
设消耗的铝的质量为x;
8Al + 3Fe3O4 | 9Fe + 4Al2O3 |
216 | 504 |
x | 25.2kg |
![]() x=10.8kg
x=10.8kg
答:消耗的铝的质量为10.8kg .
所以答案是:(1)单质;(2)c;(3)红色固体变黑;CO2+Ca(OH)2=CaCO3↓+H2O;10.8kg.
【考点精析】根据题目的已知条件,利用一氧化碳还原氧化铁和书写化学方程式、文字表达式、电离方程式的相关知识可以得到问题的答案,需要掌握原理:在高温下,利用焦炭与氧气反应生成的一氧化碳把铁从铁矿石里还原出来;注意:a、配平 b、条件 c、箭号.
