题目内容
【题目】下列对实验现象的观察和记录正确的是
A. 电解水实验中正负极产生的气体体积之比是2:1
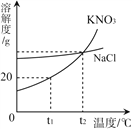
B. 室温下向饱和食盐水中加入少量硝酸钾固体,搅拌,固体溶解
C. 向蒸馏水中滴入2~3滴植物油,搅拌,植物油完全溶解
D. 一般情况下,铁丝能在空气中燃烧,火星四射。
【答案】B
【解析】A. 电解水实验中正负极产生的气体体积之比是1:2.故A错误。B. 室温下向饱和食盐水中加入少量硝酸钾固体,搅拌,固体溶解。一种溶剂中可以同时溶解几种单质。故B正确。C. 向蒸馏水中滴入2~3滴植物油,搅拌,植物油不会完全溶解。故C错误。D. 一般情况下,铁丝不能在空气中燃烧,火星四射。故D错误。
点睛∶本题主要考查实验现象的观察和记录。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目