题目内容
【题目】如图是配制100g溶质质量分数为12.5%的NaCl溶液的有关实验操作示意图.
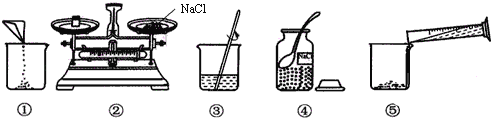
(1)用如图表示的序号配制溶液的正确操作顺序 .
(2)配置过程中使用的四种玻璃仪器,分别是广口瓶、 、 量筒.
(3)请你指出图中一处错误操作 ,并分析该操作可能造成的后果 .
(4)图③表示的操作步骤是 .
(5)配制时需称量氯化钠 g,如果氯化钠中含有少量不溶的杂质,溶质的质量分数会 (填“偏大”或“偏小”);量取水最好选择的量筒 (填序号①10mL ②50mL③100mL).(水的密度为1g/cm3)
【答案】(1)④②①⑤③(2)玻璃棒、烧杯;
(3)②;所得溶液质量分数偏小;(4)溶解;
(5)12.5; 偏小; ③.
【解析】(1)100g溶质质量分数为12.5%的NaCl溶液的步骤:计算、称量(量取)、溶解、装瓶贴签,用图示的序号表示为:④②①⑤③.
(2)通过分析可知,配制过程中使用的四种玻璃仪器,分别是广口瓶、玻璃棒、烧杯、量筒;
(3)托盘天平使用前校零,使用时左物右码,m(物体)=m(砝码)+m(游码).图②中是左盘砝码右盘游码,此时m(砝码)=m(物体)+m(游码),所称药品质量小于实际所需质量.
(4)根据图示很明显看出溶解的步骤;
(5)溶质的质量=溶液的质量×溶质的质量分数=100g×12.5%=12.5g,氯化钠中含杂质,溶质的量变少,故质量分数偏小.溶剂水的质量为100g﹣12.5g=87.5g,通过密度可求算出水的体积为87.5mL,选择的100mL的量筒.

练习册系列答案
相关题目