题目内容
【题目】实验中学化学兴趣小组为了测定某含铁样品中铁的质量分数,取10克样品放入烧杯中,再取稀盐酸分五次加入烧杯中,每次均充分反应(杂质不溶于水,也不参加反应),测得实验数据如下:求:(1)此含铁样品中铁的质量分数。(2)恰好完全反应时所得溶液中溶质的质量分数。
【答案】(1)56% (2)12.7%
【解析】
试题分析:(1)根据表格中数据可知,样品中铁的质量为10克-4.4克=5.6克,再用铁的质量除以样品的质量即可。(2)根据铁的质量,利用化学方程式计算出氯化亚铁质量,再计算出氯化亚铁溶液质量即可。
解:(1)含铁样品中铁的质量分数(![]() )×100%=56%…(2分)
)×100%=56%…(2分)
(2)据表中数据可知,加入第四次稀盐酸后,样品中的Fe与盐酸恰好完全反应。
设此时生成FeCl2的质量为X,则
Fe+2HCl=FeCl2+H2↑
56 127
10g-4.4g X
![]() =
=![]() x=12.7g…………(2分)
x=12.7g…………(2分)
恰好完全反应时所得溶液的溶质质量分数为:
![]() ×100%=
×100%=![]() ×l00%=12.7%………………………(2分)
×l00%=12.7%………………………(2分)
答.略(无答案和题设时扣1分)

练习册系列答案
相关题目
【题目】石灰石样品的主要成分是CaCO3(已知其它杂质不与盐酸反应).课外小组同学将50g盐酸分5次加入到20g该石灰石样品中,得到如下部分数据和图象:
次数 | 第1次 | 第2次 | 第3次 |
加入盐酸的质量/g | 10 | 10 | 10 |
剩余固体的质量/g | 16 | 12 | 8 |
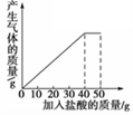
请计算:
(1)石灰石样品中杂质的质量为 g。
(2)所加盐酸的溶质质量分数.