题目内容
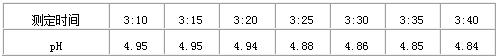
某校“酸雨”(pH<5.6)测量小组的同学,取刚降落雨水的水样,用pH探头(测pH的仪器)每隔几分钟测一次pH,其数据如下:
(1)”正常雨水”(不是酸雨)的pH<7,根据所学的有关知识,解释引起这种pH的原因是
(2)根据以上数据,判断所降雨水是否为“酸雨”(填是或否)
(3)经调查,这一地区有一个硫酸厂(生产过程产生SO2)和一个电镀厂,这些厂使用的燃料主要是煤.试分析造成这一地区酸雨的主要原因是
(4)工业上,常用
| 测定时刻 | 5:05 | 5:10 | 5:15 | 5:20 | 5:25 | 5:30 | 5:35 |
| PH | 4.95 | 4.94 | 4.94 | 4.88 | 4.86 | 4.85 | 4.85 |
空气中含有二氧化碳,溶于雨水,因此雨水呈酸性
空气中含有二氧化碳,溶于雨水,因此雨水呈酸性
;(2)根据以上数据,判断所降雨水是否为“酸雨”(填是或否)
是
是
;(3)经调查,这一地区有一个硫酸厂(生产过程产生SO2)和一个电镀厂,这些厂使用的燃料主要是煤.试分析造成这一地区酸雨的主要原因是
硫酸厂生产过程产生的SO2和电镀厂煤燃烧也生成SO2
硫酸厂生产过程产生的SO2和电镀厂煤燃烧也生成SO2
.(4)工业上,常用
氢氧化钠
氢氧化钠
除去尾气中的SO2,其原理用化学方程式表示为2NaOH+SO2=Na2SO3+H2O
2NaOH+SO2=Na2SO3+H2O
.分析:根据已有的知识进行分析,溶液的pH小于7,溶液呈酸性,二氧化碳能与水反应生成碳酸,酸雨是指pH<5.6的雨水,煤中含有的硫元素会转化生成二氧化硫,二氧化硫能与氢氧化钠反应生成亚硫酸钠和水.
解答:解:(1)二氧化碳能与水反应生成碳酸,碳酸呈酸性,故填:空气中含有二氧化碳,溶于雨水,因此雨水呈酸性;
(2)是该雨水的pH<5.6,属于酸雨,故填:是;
(3)煤中含有的硫元素会转化生成二氧化硫,硫酸厂生产过程产生SO2,二氧化硫能与水反应生成亚硫酸,形成酸雨,故填:硫酸厂生产过程产生的SO2和电镀厂煤燃烧也生成SO2;(4)二氧化硫能与氢氧化钠反应生成亚硫酸钠和水,从而除去二氧化硫,故填:氢氧化钠,2NaOH+SO2=Na2SO3+H2O.
(2)是该雨水的pH<5.6,属于酸雨,故填:是;
(3)煤中含有的硫元素会转化生成二氧化硫,硫酸厂生产过程产生SO2,二氧化硫能与水反应生成亚硫酸,形成酸雨,故填:硫酸厂生产过程产生的SO2和电镀厂煤燃烧也生成SO2;(4)二氧化硫能与氢氧化钠反应生成亚硫酸钠和水,从而除去二氧化硫,故填:氢氧化钠,2NaOH+SO2=Na2SO3+H2O.
点评:本题考查了溶液的酸碱性与pH的关系,完成此题,可以依据已有的知识进行.要求同学们熟练掌握有关物质的性质,以便灵活应用.

练习册系列答案
 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案
相关题目