题目内容
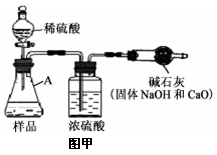
(7分)甲同学将燃烧的钠迅速伸入到盛有纯净干燥的CO2的集气瓶中,发现金属钠在CO2中继续燃烧,燃烧停止后,在集气瓶底发现有黑色颗粒生成,瓶内壁上有白色物质生成。
(1)甲认为黑色颗粒是 (用化学式填空),白色物质可能是Na2O或Na2CO3;乙同学认为白色物质还有可能是氢氧化钠固体。甲同学认为乙同学的猜想不正确,其理由是 ;
(2)查阅资料发现:氧化钠为白色粉末,溶于水生成氢氧化钠:Na2O+H2O=2NaOH。甲同学据此对白色物质进行了下列实验:
(3)丙同学认为方案1得到的结论不正确,理由是:
(4)钠在二氧化碳中燃烧的化学方式为: ,属于基本反应类型中的 反应。
(1) C;反应物中不存在氢元素 (2)碳酸钠; (3)碳酸钠的溶液也呈碱性
(4) 4Na+3CO2点燃2Na2CO3+C;置换
解析试题分析:(1) 反应物为钠和二氧化碳,所含的元素种类钠、碳、氧三种。所以该黑色颗粒可能是碳,化学式为C。反应物中不存在氢元素,所以不可能为氢氧化钠。
(2)方案2中步骤①加入的氯化钙可与碳酸钠反应生成碳酸钙沉淀,可说明白色物质中含碳酸钠;②加入无色酚酞无明显现象,可说明白色物质中不含氢氧化钠。所以白色物质为碳酸钠;
(3) 加入无色酚酞溶液呈红色,说明溶液呈碱性。而如是碳酸钠的溶液也呈碱性,所以无法确认一定含氢氧化钠。
(4)根据题意可知:钠在二氧化碳中燃烧会生成碳和碳酸钠,所以反应的化学方程式为:4Na+3CO2点燃2Na2CO3+C;该反应符合“一种单质和一种化合物生成另一种单质和另一种化合物”的特点,属于置换反应。
考点:科学探究、化学方程式的书写

 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案有一种神奇的蜡烛,点一任你怎么吹也吹不灭,而且看上去和普通的蜡烛一模一样,那么到底是什么玄机能让蜡烛持续燃烧?请你一起参与探究.
查阅资料:普通蜡烛由石蜡和蜡烛芯制成,而吹不灭的蜡烛是在蜡烛芯上包裹一层打火石的粉末,打火石是由某种金属掺入少量稀土元素制成的合金,它的着火点只有150℃,当蜡烛燃烧时,金属并不燃烧;但当蜡烛吹灭后,未冷却的金属接触到氧气就发生燃烧,从而使蜡烛复燃.
老师告诉同学们,蜡烛芯内打火石中的某种金属可能是镁、铁或铜中的一种,为确定该金属的成分,大家设计了以下实验方案,请你填空和回答有关问题(注:不考虑打火石中稀土元素对探究金属性质的影响).
| 实验 | 操作步骤 | 实验现象 | 实验结论 |
| 1 | 切开蜡烛,取出打火石,用砂纸打磨 | 打火石呈银白色 | 该金属一定不是 . |
| 2 | 取少量打磨后的打火石于试管中,滴加稀盐酸 | 有无色气体产生, | 该金属一定不是铁,而是镁 |
(1)实验2中反应的化学方程式为 .
(2)这种蜡烛燃烧时,蜡烛芯里的金属为什么不燃烧?
(3)这种“吹不灭”的蜡烛实际上也可以熄灭,你采用的方法是 .
(10分)兴趣小组同学为了探究实验室中久置的氢氧化钠固体的成分,进行了有关实验:
(1)氢氧化钠固体要密封保存,原因有:
① ;② 。
【对固体猜想】
猜想一:全部是NaOH;猜想二:全部是Na2CO3;猜想三:是NaOH和Na2CO3混合物
【实验和推断】(2)为进一步确定成分,进行了以下探究:
对无色溶液进行以下实验:
| 实验操作 | 实验现象 | 实验结论 |
| 第一步: 用试管取约2mL该溶液,滴入适量氢氧化钙溶液,振荡。 | 现象a:白色沉淀 | 化学方程式: ① , 有碳酸钠并全部除尽。 |
| 第二步: 静置,取上层清液于试管中滴入酚酞溶液,振荡。 | 现象b: ② | 含有NaOH,猜想三成立,是NaOH和Na2CO3混合物 |
。
④反思:把第一步中的氢氧化钙溶液换成 溶液,可达到实验目的。
(3)请利用以下提供的试剂,设计实验证明猜想一是正确的,即氢氧化钠没有变质。
提供的试剂有:酚酞溶液、稀盐酸、氢氧化钡溶液、氯化钡溶液
| 实验操作 | 实验现象 | 实验结论 |
| | | |
(6分)人类的生产和生活都离不开金属。
(1)金属的应用非常广泛。
①汽车电路中的导线大都是铜制的,这是利用了金属铜的延展性和________性。
②铁是生产和生活中使用最多的金属,下列关于铁的叙述不正确的是________。
| A.铁生锈时生成四氧化三铁 | B.表面涂漆以防止铁生锈 |
| C.铁制品应放置于干燥的环境中 | D.应及时回收废弃的的铁制品 |

在A实验中发生反应的化学方程式为________________,反应类型为________。将A实验结束后①、②试管内的物质倒入烧杯中,发现烧杯中的红色固体物质明显增多,一段时间后过滤,滤渣中的物质所有可能的组成为________,滤液中的溶质可能为________(填写以下序号)。
①Al2(SO4)3②Al2(SO4)3、FeSO4③Al2(SO4)3、Fe2(SO4)3
④FeSO4、CuSO4⑤Al2(SO4)3、FeSO4、CuSO4
有一包固体样品,可能是碳酸钠、硫酸铜、氢氧化钠、氯化钡中的一种或几种。为探究其成分,李老师取用一定量样品,加水溶解,过滤得到白色沉淀甲和无色滤液乙。
【探究活动一】自主小组探究白色沉淀甲的成分。
| 实验操作 | 实验现象 | 结论 |
| 取白色沉淀甲,滴加足量的稀盐酸 | 沉淀消失 | 白色沉淀甲中一定含有 |
| 实验步骤 | 实验操作 | 实验现象 | 结论 |
| 1 | 取无色滤液乙,加入碳酸钠溶液 | 无明显现象 | 无色滤液乙中一定不含氯化钡 |
| 2 | 取适量无色滤液乙,加入过量的 溶液,过滤 | 生成白色沉淀 | 无色溶液中一定含有碳酸钠 |
| 3 | 取实验步骤2中的滤液,滴加 溶液 | | 原固体样品中一定存在氢氧化钠 |
【结论】通过两个小组的共同探究,得出了原固体样品中含有的成分。
有一种神奇的蜡烛,点燃后任你怎么吹也吹不灭,而且看上去和普通的蜡烛一模一样,
到底是什么玄机能让蜡烛持续燃烧?请你一起参与探究。
【查阅资料】普通蜡烛由石蜡和蜡烛芯制成的,而吹不灭的蜡烛是在蜡烛芯上包裹一层打火石的粉末。打火石是由某种金属掺入少量稀土元素制成的合金,它的着火点只
有150℃。当蜡烛燃烧时,金属并不燃烧;但当蜡烛吹灭后,未冷却的金属接触到氧气就发生燃烧,从而使蜡烛复燃。
【探究与反思】这种蜡烛燃烧时,蜡烛芯里的金属为什么不燃烧? ,这种蜡烛也可以熄灭,你采用的方法是 。
【实验探究】吹不灭的蜡烛芯内的金属可能是镁、铝、铁或铜中的一种,为确定该金属的成分,请你继续探究并完成下列有关问题:(注:不考虑打火石中稀土元素对探究金属性质的影响)
| 实验 | 操作步骤 | 现象 | 结论 |
| 1 | 切开蜡烛,取出打火石,用砂纸打磨 | 打火石是银白色 | |
| 2 | | | 该金属一定不是铁 |
| 3 | 取少量打磨后的打火石于试管中,滴加硫酸铜溶液。 | 有红色物质析出 | 该金属一定是镁 |
(1)请写出“实验3”中可能涉及到的化学方程式 。
(2)有同学认为通过“实验3”中现象不能证明烛芯内的金属一定是镁,因为 。
(3)针对以上实验,请你设计一个合理的实验方案来进一步验证这种金属,
| 操作步骤 | 现象 | 结论 |
| | | |