题目内容
【题目】分别用两种方法测定10g铜锌合金中锌的含量。
加入的试剂 | 测得数据 | |
方法1 | 足量稀硫酸 | 气体0.2 g |
方法2 | 足量硫酸铜溶液 | 固体质量减少0.1 g |
请任选1种方法的数据,计算合金中锌的质量分数(写出计算过程及结果)。
_______
【答案】65%
【解析】方法1:根据质量守恒定律的应用:位于氢前面的金属能把酸中的氢置换出来生成氢气。铜锌合金中只有锌能与稀硫酸反应生成氢气。故可利用化学方程式,根据氢气的质量计算出锌的质量。
设合金中锌的质量为x;
Zn + H2SO4 === ZnSO4 + H2↑
65 2
X 0.2g
![]()
![]() x=6.5g
x=6.5g
合金中锌的质量分数=![]() =65%
=65%
方法2:根据金属活动性顺序的应用:位于前面的金属能把位于后面的金属从化合物的溶液中置换出来。故铜锌合金加入硫酸铜溶液中,锌能与硫酸铜反应生成铜和硫酸锌,可利用差量法计算出锌的质量。
设锌的质量为x;
Zn + CuSO4 === ZnSO4 + Cu 固体减少的质量
65 64 65-64=1
X 0.1g
![]()
合金中锌的质量分数=![]() =6.5%
=6.5%
答:合金中锌的质量分数为6.5%。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】根据所给微粒结构示意图判断,下列说法错误的是
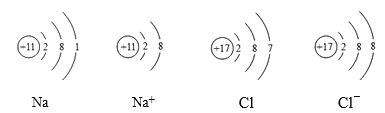
A. 钠原子在化学反应中易失去1个电子
B. 氯离子核内有17个质子
C. Na+与Cl-的最外层电子数相等
D. 元素的化学性质是由原子的质子数决定的
【题目】实验室里用过氧化氢溶液与二氧化锰制取氧气,相关数据如下:
反应前物质的质量/g | 充分反应后物质的质量/g | |
过氧化氢溶液 | 二氧化锰 | 固体与液体混合物质量 |
136.0 | 0.2 | 133.0 |
请计算:
Ⅰ.制得氧气的物质的量为_________。
Ⅱ.该实验中反应的过氧化氢的物质的量(根据化学方程式计算)。
______________
Ⅲ.理论上该实验所用过氧化氢溶液的溶质质量分数为___________________。