题目内容
【题目】向盛有一定质量稀硫酸的烧杯中逐渐加入10g锌粒,产生气体质量与锌粒质量的关系如图所示;充分反应后,称得烧杯中剩余物质总质量为109.8g.请根据关系图分析并计算: 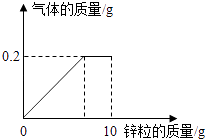
(1)稀硫酸反应完时,产生氢气的质量为g,消耗锌粒质量为g.
(2)该稀硫酸中溶质的质量分数(写出计算过程).
【答案】
(1)0.2;6.5
(2)解:该稀硫酸中溶质的质量分数: ![]() =9.8%
=9.8%
答:该稀硫酸中溶质的质量分数是9.8%
【解析】解:(1)由关系图可知,反应后生成氢气的质量为0.2g,
设锌的质量为x,稀硫酸中溶质的质量为y,
Zn+ | H2SO4═ZnSO4+ | H2↑ |
65 | 98 | 2 |
x | y | 0.2g |
![]() 解得:x=6.5g y=9.8g
解得:x=6.5g y=9.8g
根据关系图分析生成的氢气的质量,由氢气的质量可求出消耗锌粒质量,参加反应的硫酸中溶质的质量,再根据溶质的质量分数计算稀硫酸中溶质的质量分数.

【题目】为分析某由氧化铜和铜组成的混合物中氧化铜的质量,现取3份该混合物各20 g,分别缓慢加入到50 g、100 g、150 g某稀硫酸中,测得三组实验数据如表:
组别 | A | B | C |
稀硫酸的质量/g | 50 | 100 | 150 |
剩余固体的质量/g | 10.0 | 4.0 | 4.0 |
根据实验及有关数据进行分析与计算:
(1)实验中反应物氧化铜有剩余的是组。
(2)20 g该混合物样品中含氧化铜的质量为g。
(3)根据A组数据计算所用的稀硫酸溶质的质量分数(写出计算过程)。
(4)将B组反应后的混合物过滤,向滤液中滴加10%的NaOH溶液,画出在该混合溶液中加入10% NaOH溶液的质量与生成沉淀质量变化关系的曲线图。
提示:若溶液中溶质含有H2SO4 和CuSO4 , 则反应的先后顺序如下:
H2SO4+2NaOH=2 H2O+Na2SO4
CuSO4+2NaOH=Cu(OH)2↓+Na2SO4