题目内容
【题目】下图是四位同学用氯酸钾制取氧气的实验,其中能正确反映实验的是()
A.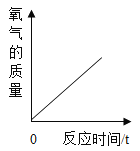 直接加热氯酸钾固体制取氧气
直接加热氯酸钾固体制取氧气
B.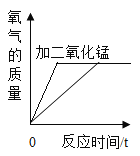 加热两份等质量的氯酸钾固体,其中一份加二氧化锰作催化剂
加热两份等质量的氯酸钾固体,其中一份加二氧化锰作催化剂
C.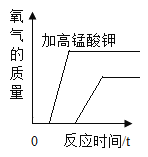 加热两份等质量的氯酸钾固体,其中一份错把高锰酸钾当成二氧化锰作催化剂
加热两份等质量的氯酸钾固体,其中一份错把高锰酸钾当成二氧化锰作催化剂
D.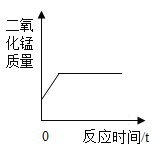 加热氯酸钾和二氧化锰固体,其中二氧化锰的质量
加热氯酸钾和二氧化锰固体,其中二氧化锰的质量
【答案】B
【解析】
A、直接加热氯酸钾固体制取氧气,由于没有加入催化剂,反应产生的氧气气体体积较少,且氯酸钾固体的质量一定,当氯酸钾完全反应后就不再有氧气产生,图像氧气质量一直在增加,故图像不符合实验;
B、加热两份等质量的氯酸钾固体,其中一份加二氧化锰作催化剂,加入二氧化锰的反应速率更快,完全反应的时间更短,故图像符合实验;
C、加热两份等质量的氯酸钾固体,其中一份错把高锰酸钾当成二氧化锰作催化剂,加高锰酸钾的一开始会产生少量氧气和二氧化锰,随着二氧化锰的产生可以作为氯酸钾分解的催化剂,而加入二氧化锰的产生气体的速率要比加入高锰酸钾的快,但是产生气体的总质量会比加入高锰酸钾的少。图像不符合实验;
D、加热氯酸钾和二氧化锰固体,其中二氧化锰作为催化剂,反应后质量和化学性质都不变,图像不符合题意。
故选:B。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
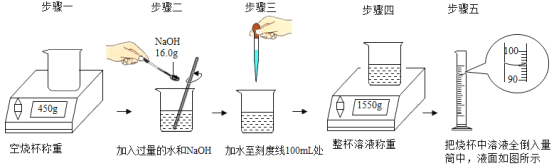
小学生10分钟应用题系列答案【题目】为测定某大理石样品中碳酸钙(杂质不溶于水也不参与反应)的质量分数,某小组的同学进行了如下实验(水和氯化氢的挥发忽略不计):取12.5g样品研碎放入烧杯中,每次加入20.8g稀盐酸后并用电子天平称量,记录实验数据如下。
加入稀盐酸次数 | 1 | 2 | 3 | 4 | 5 |
烧杯及所称物质总质量/g | 72.2 | 91.9 | 111.6 | 131.3 | 152.1 |
请计算:
⑴大理石样品中碳酸钙的质量分数;
⑵恰好完全反应时烧杯内溶液的溶质质量分数。
【题目】某实验小组对“载人宇宙飞船或潜水艇中一般都要安装盛放过氧化钠(Na2O2)
颗粒的装置”感到非常好奇,设计实验进行探究。
(提出问题)过氧化钠是否为一种制氧剂?与人呼出的哪种气体发生反应?
(查阅资料)① 人呼出的气体中主要成分是N2、O2、CO2和水蒸气等。
② CO2+2NaOH=Na2CO3+H2O。
(提出猜想)过氧化钠与人呼出的N2或CO2或水蒸气反应并生成氧气。
(进行实验)
实验Ⅰ:验证过氧化钠与氮气反应并生成氧气。
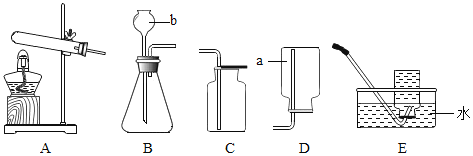
(1)实验操作如下图I所示。
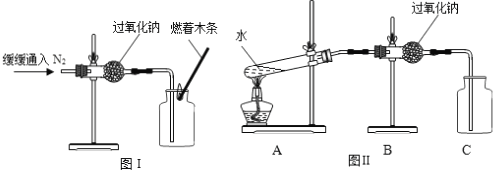
(2)实验现象及结论:观察到____________现象,判断过氧化钠与氮气没有发生反应。
实验Ⅱ:验证过氧化钠与水蒸气反应并生成氧气。
(1)同学们在老师的指导下设计了如上图II所示装置。其中A装置的作用是________,发生的变化是__________变化。
(2)实验现象及结论:带火星的木条复燃;过氧化钠与水蒸气发生反应并生成氧气。
实验Ⅲ:验证过氧化钠与二氧化碳反应并生成氧气。
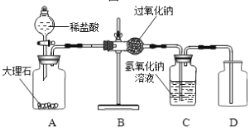
(1)同学们在老师的指导下设计了如图所示装置。
你若能正确回答出以下问题,你将获得4分的奖励。但试卷总分不得超过60分
(2)实验记录
实验操作 | 主要实验现象 | 实验结论及解释 | |
① | 检查装置的气密性。向装置中加入药品。 | 装置的气密性良好。 | |
② | 打开分液漏斗活塞,向A装置中缓慢加入稀盐酸。 | A装置中观察到的现象有________,C装置中有气泡出现。 | C装置作用是_______。 |
③ | 一段时间后用带火星的木条在D内进行检验。 | 带火星的木条复燃。 | 过氧化钠与二氧化碳反应并生成氧气。 |
(实验反思)
(1)根据实验Ⅱ和Ⅲ,过氧化钠与二氧化碳或水蒸气反应后,还产生了另一种物质,该物质是________(填“单质”或“化合物”)。
(2)某同学对实验Ⅲ的设计提出疑问:该实验不能证明二氧化碳与过氧化钠确实发生了反应,你认为他的理由是_________________________。
【题目】叠氮化钠(NaN3)被广泛应用于汽车安全气囊,某兴趣小组对其进行下列研究.
(应用研究)
(1)汽车经撞击后,30毫秒内引发NaN3,迅速分解为Na、N2,反应方程式为_______。
(制备研究)
(2)将金属钠与液态氨反应得NaNH2,再将NaNH2与N2O反应可生成NaN3、NaOH和
气体X,该反应的化学方程式为2NaNH3+N2O = NaN3+NaOH+X,实验室检验X
气体使用的试纸是湿润________。
(Na2CO3质量分数测定)
工业级NaN3中常含有少量的Na2CO3,为测定样品中Na2CO3的质量分数设计如图装置(已知H2SO4溶液与NaN3,反应不生成气体)。
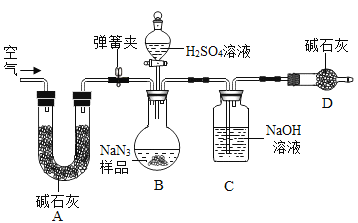
(3)装置A的作用是_____。设计的实验步骤为:①精确称量样品,检查装置气密性;②打开弹簧夹,鼓入空气,称量装置C;③关闭弹簧夹,打开分液漏斗活塞;④再打开弹簧夹,_______;⑤再次称量装置C。计算碳酸钠含量至少需要测定______(填数字)个数据。根据制备反应,分析工业级NaN3中含有Na2CO3的可能原因_______。
M |
(NaN3纯度测定)精确称量0.140 g NaN3样品,设计如图装置,测定其纯度。已知2 NaN3→ 3N2
(NaN3中的N全部转化为N2,其他产物略),反应中放出大量的热。
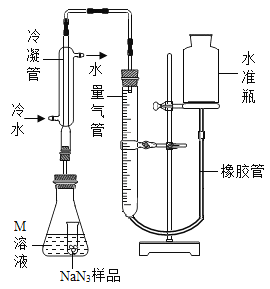
(4)检查该装置气密性的方法是连接好装置,从水准瓶注水,量气管中液面与右边液面形成高度差,做好标记,一段时间后,两边高度差_____(填“变大”、“变小”或“不变”),说明气密性良好。
(5)使小试管中的NaN3样品与M溶液接触的操作是______。
(6)使用冷水冷凝的目的是______。反应前应将液面调节到量气管的“0”刻度,并使两边液面相平,反应后读数时,还需要进行的操作是_______。
(7)常温下测得量气管读数为67.2 mL(N2的密度为1.25 g/L),则实验中选用的量气管规格合适的是_____(填字母序号)。
A. 100 mL B. 1 L C. 2 L
(8)计算NaN3样品的纯度(写出计算过程)。