题目内容
【题目】(6分)某化学探究小组用如下实验证明了烧碱与稀硫酸能发生中和反应。
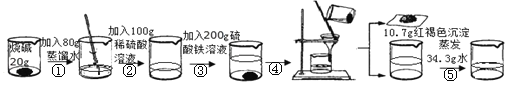
②③两步均充分反应,加入硫酸铁溶液,立即产生明显现象,最终得到只含一种溶质的无色溶液。请回答下列问题:
(1)根据发生的反应及现象可知反应②结束时溶液中的离子有① (填离子符号);
②无明显现象,发生反应的化学方程式是② ;
(2)求解③中参加反应的烧碱的质量(X)的比例式为 ;
(3)发生中和反应的烧碱的质量为 ;
(4)最终得到的无色不饱和溶液只含一种溶质,则所得溶液中溶质的质量分数为 ;
(5)若用98%的浓硫酸配制实验中所用的稀硫酸,在图中标出所用浓硫酸与蒸馏水的质量。
【答案】(1)①Na+、OH-、SO42- ②H2SO4+2NaOH= Na2SO4+ 2H2O
(2)214:240=10.7g:x
(3)8g (4)10% (5)图略
【解析】
试题分析:(1)①根据③加入硫酸铁溶液,立即产生明显现象,说明发生的反应:Fe2(SO4)3+6NaOH==2Fe(OH)3↓+3Na2SO4,现象为:有红褐色沉淀生成,故可知反应②结束时,碱过量,故溶液中的离子有Na+、OH-、SO42-
②无明显现象,发生反应的化学方程式是:H2SO4+2NaOH= Na2SO4+ 2H2O
(2)根据化学方程式:Fe2(SO4)3+6NaOH==2Fe(OH)3↓+3Na2SO4中红褐色沉淀Fe(OH)3与NaOH的质量关系为214:240,设NaOH的质量为x,参加反应的烧碱的质量 (X)的比例式为:214:240=10.7g:x
(3)根据(2)的比例式214:240=10.7g:x,,可求出x=12g,故发生中和反应的烧碱的质量=20g-12g=8g(4)根据上面的分析,最终得到的无色不饱和溶液只含一种溶质,即为Na2SO4,根据质量守恒定律,Na2SO4 中Na元素的质量等于NaOH中所含的Na元素的质量,故可设溶质Na2SO4的质量为y,则可列式为:y×46/142×100%=20g×23/40×100%,,y=35.5g,反应后所得溶液质量=反应前各物质质量总和-反应生成的气体、沉淀或杂质,故所得溶液质量=20g+80g+100g+200g-10.7g-34.3g=355g,故所得溶液中溶质的质量分数=35.5g/355g×100%=10%
(5)根据步骤②中发生的反应:H2SO4+2NaOH= Na2SO4+ 2H2O中NaOH与H2SO4的质量关系,可计算出H2SO4的质量
解:设H2SO4的质量为z
H2SO4+2NaOH= Na2SO4+ 2H2O
98 80
z 8g
98:80=z:8g
Z=9.8g
再抓住溶液稀释的过程中,溶质的质量不变,故可设所用浓硫酸的质量为W,列式为:
W×98%=9.8g
W=10g
故所需水的质量=100g-10g=90g
标签略

【题目】在一个密闭容器内放入X、Y、Z、W四种物质,一定条件下发生化学反应,一段时间后,测得有关数据如下表。
物质 | X | Y | Z | W |
反应前质量(g) | 2 | 1 | 16 | 16 |
反应后质量(g) | 12 | m | 8 | 14 |
(1)m = 。
(2)参加反应的Z与W的质量比为 。