题目内容
【题目】小明取酸性锌锰干电池进行研究,他发现电池内部结构如图1所示. 
[查阅资料]①锌皮为金属锌(含有少量的铁)
②黑色糊状填充物由炭黑、MnO2、ZnCl2和NH4Cl等组成
③有关数据见下表
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度/g | NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 | |
[实验探究一]小明取适量黑色糊状填充物,按如图2所示实验流程进行探究.
(1)溶液A中溶质主要有(填化学式),操作Ⅱ中采用冷却热饱和溶液的方法实现两者分离的依据是.
(2)欲从固体M中得到较纯的MnO2 , 操作Ⅲ可采用简便方法是.
(3)[实验探究二]小明取电池外壳锌皮,用砂纸打磨干净,剪成小块,进行实验. 取一块锌皮放入盛有适量稀盐酸的烧杯中,有ZnCl2生成.
①实验中可观察到的现象是;该反应属于基本反应类型中的反应.
②下列各组物质混合后,也能生成ZnCl2的有(填字母序号).
A.ZnO与稀盐酸
B.ZnSO4溶液与BaCl2溶液
C.ZnCO3与NaCl溶液
D.Zn(NO3)2溶液与NH4Cl溶液
(4)另取一块锌皮放入盛有一定量CuSO4溶液的烧杯中,充分反应后得到溶液E和固体F.当溶液E中只含有一种溶质时,该溶质是(填化学式);当固体F中只含一种物质时,溶液E中最少含有种溶质.
(5)若将6.5g锌皮与足量稀硫酸完全反应,则生成氢气的质量0.2g(选填“<”、“=”或“>”).
【答案】
(1)ZnCl2和NH4Cl;氯化锌的溶解度受温度影响变化大(或二者的溶解度随温度变化不同)
(2)灼烧
(3)锌的表面有气泡产生;置换;AB
(4)ZnSO4;一
(5)>
【解析】解:[实验探究一](1)糊状物中的二氧化锰和炭黑不易溶于水,氯化锌和氯化铵溶于水,因此溶于水后得到溶液A中含有氯化锌和氯化铵;观察表格可知氯化锌的溶解度受温度影响变化大,因此可以采用冷却热饱和溶液的方法进行分离;所以答案是:ZnCl2和NH4Cl;氯化锌的溶解度受温度影响变化大(或二者的溶解度随温度变化不同);(2)炭黑能够和氧气反应,而二氧化锰不能灼烧,因此分离出二氧化锰可以采用灼烧的方式;所以答案是:灼烧; [实验探究二]①锌和盐酸反应产生氢气,因此观察到的现象为有气泡产生,该反应属于置换反应;所以答案是:有气泡产生;置换;②A.ZnO与稀盐酸能反应产生氯化锌和水,故正确;
B.ZnSO4溶液与BaCl2溶液反应产生硫酸钡沉淀和氯化锌,故正确;
C.ZnCO3与NaCl溶液混合,碳酸锌不溶于水,因此不能和氯化钠反应,故错误;
D.Zn(NO3)2溶液与NH4Cl溶液不能产生沉淀、气体或水,不符合复分解反应的条件,故错误;
所以答案是:AB;(4)锌和硫酸铜反应产生硫酸锌和铜,当溶液E中只含有一种溶质时,说明硫酸铜钡完全反应,因此溶质只有硫酸锌;
当固体F中只含一种物质时,该是置换出的固体一定是铜,说明锌没有剩余,因此锌可能是恰好反应,溶质只有硫酸锌,也可能是锌不足,溶液中还有硫酸铜,因此溶质还有硫酸铜,因此溶液E中最少含有一种溶质;
所以答案是:ZnSO4;一;(5)假设该样品全部是锌,则生成氢气的量为x
Zn+H2SO4=ZnSO4+ | H2↑ |
65 | 2 |
6.5g | x |
![]() =
= ![]() x=0.2g
x=0.2g
假设该样品全部是铁,则生成氢气的量为x
Fe+H2SO4=FeSO4+ | H2↑ |
56 | 2 |
6.5g | x |
![]() =
= ![]() x=0.23g
x=0.23g
因此二者混合物产生的氢气应该大于0.2g;
所以答案是:>.
【考点精析】本题主要考查了结晶的原理、方法及其应用和金属材料的选择依据的相关知识点,需要掌握结晶的两种方法:蒸发溶剂,如NaCl(海水晒盐)和降低温度(冷却热的饱和溶液,如KNO3);黑色金属:通常指铁、锰、铬及它们的合金.重金属:如铜、锌、铅等;有色金属轻金属:如钠、镁、铝等;有色金属:通常是指除黑色金属以外的其他金属才能正确解答此题.

【题目】根据提供的实验装置回答问题. 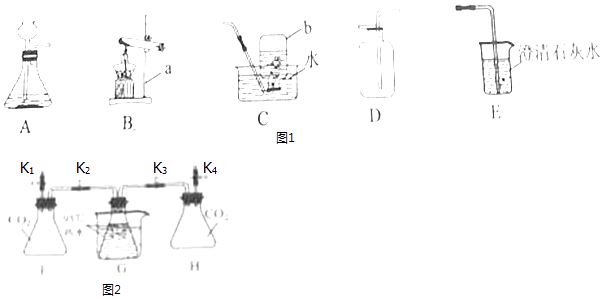
(1)写出仪器名称:a为;b为
(2)实验室用B装置制取O2 , 发生反应的化学方程式为 .
(3)实验室制取CO2的发生和收集装置是(填字母序号),CO2通过E装置可观察到的实验现象是 . 小明在实验中用C装置收集到一瓶CO2 , 为了弄清其中道理,他采取的科学态度和方法是(填数字序号). ①置之不理 ②查阅资料 ③交流讨论 ④请教老师
(4)CO2能与NaOH发生反应. [实验过程]检查装置气密性,如图2所示连接好装置,进行实验.
序号 | 操作步骤 | 实验现象 |
Ⅰ | 打开弹簧夹K1 , 关闭弹簧夹K2、K3、K4 . 将20mL水注入锥形瓶F中,关闭弹簧夹K1 , 振荡瓶G,打开弹簧夹K2 | 无明显现象 |
Ⅱ | 关闭弹簧夹K2 , 打开弹簧夹K4 , 将20mL NaOH溶液注入锥形瓶H中,关闭弹簧夹K4 , 振荡瓶H,打开弹簧夹K1 | 锥形瓶G中的热水剧烈沸腾 |
[实验分析]锥形瓶G在热水剧烈沸腾的原因是 .
[实验反思]有观点认为只需要进行实验操作Ⅱ,即可说明CO2与NaOH发生反应.你对该观点的看法是(选填“赞同”或“不赞同”),理由是 .