题目内容
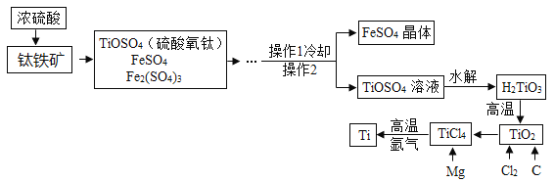
【题目】钛和钛合金被认为是21世纪的重要金属材料,它们具有很多优良的性能,如熔点高,密度小,可塑性好等。以钛铁矿(主要成分为FeTiO3,同时含有少量的Fe2O3、FeO等)为原料制TiO2,再由TiO2制金属Ti的工艺流程如图所示。
[查阅资料]钛、镁在高温下与空气中的氧气、二氧化碳等反应。
(1)硫酸氧钛(TiOSO4)中钛元素的化合价_________。
(2)操作2的名称是_______;
(3)工艺流程中,水解属于_________(填“物理变化”或“化学变化”);
(4)工业上常在高温和氩气氛围中,用金属镁和TiCl4反应的方法制备Ti,同时生成MgCl2,该反应的基本类型属于_________;
(5)TiO2可与焦炭、氯气在高温下反应,该反应中氯气和碳的质量按71:12的比例参加反应,反应的化学方程式为__________________。
【答案】+4 过滤 化学变化 置换 TiO2+2C+2Cl2![]() TiCl4+2CO
TiCl4+2CO
【解析】
(1)在硫酸氧钛(TiOSO4)中,氧元素显-2价,硫酸根离子显-2价,所以钛元素的化合价为+4;
(2)操作2是分离固体与液体的方法,是过滤操作;
(3)水解过程中有新物质生成了,所以发生的属于化学变化;
(4)氩气是一种稀有气体,化学性质稳定,该反应在氩气的环境中进行就是利用了其化学性质稳定,防止了钛、镁在高温时被氧化,在高温和氩气氛围中,金属镁和以TiCl4反应生成氯化镁和金属Ti,该反应属于置换反应;
(5)反应中氯气和碳的质量按71:12的比例参加反应,即反应中氯气与碳的化学式前面的化学计量数之比为:![]() :
:![]() =1:1,所以TiO2与焦炭、氯气在高温下反应,生成四氯化钛和一氧化碳,化学方程式为:TiO2+2C+2Cl2
=1:1,所以TiO2与焦炭、氯气在高温下反应,生成四氯化钛和一氧化碳,化学方程式为:TiO2+2C+2Cl2![]() TiCl4+2CO。
TiCl4+2CO。

 智趣暑假温故知新系列答案
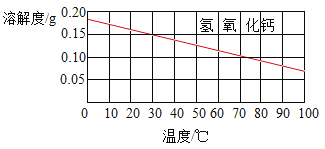
智趣暑假温故知新系列答案【题目】为了帮助同学们更好的理解空气中氧气含量测定的实验原理,老师利用传感器技术实时测定了实验装置图中图1内的压强、温度和氧气浓度,三条曲线变化如图2所示。

(1)X曲线表示的是_____(填“温度”或“氧气的浓度”)。
(2)结合X、Y两条曲线,解释图2中BC段气压变化的原因是_______。
(3)实验中测得的数据如下:
实验前 | 实验后 | ||
测量项目 | 烧杯中水的体积 | 烧杯中剩余水的体积 | 瓶中剩余气体的体积 |
体积/mL | 80.0 | 46.4 | 126.0 |
根据实验数据计算:测得的空气中氧气的体积分数为_____(列出计算式即可)。
(4)若测得的实验结果明显偏小,可能的原因是①______;②________。