题目内容
(2012?营口)请仿照示例完成下表.
绝对的“适量”是一种理想化状态,现实操作很难实现.请简述如何操作可以使示例中所加的BaCl2溶液接近“适量”?
| 物质 (杂质) | 选用试剂 | 操 作 方 法 | |
| 示例 | 盐酸 (H2SO4) |
BaCl2溶液 | 加入适量BaCl2溶液充分反应后过滤 |
| 1 | NaCl溶液 (Na2CO3) |
||
| 2 | CuSO4溶液 (H2SO4) |
分析:根据原物质和杂质的性质选择适当的除杂剂和分离方法,所谓除杂(提纯),是指除去杂质,同时被提纯物质不得改变.除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质.
解答:解:1.要除去NaCl溶液中的Na2CO3,实质就是除去碳酸根离子,可利用碳酸钠与适量的稀盐酸充分反应生成氯化钠、水和二氧化碳,能除去杂质且没有引入新的杂质,符合除杂原则.
2.要除去CuSO4溶液中的H2SO4,实质就是除去氢离子,可利用硫酸与氧化铜粉末充分反应生成硫酸铜和水,能除去杂质且没有引入新的杂质,符合除杂原则.
使所加的BaCl2溶液接近“适量”,可向盐酸和H2SO4的混合溶液中滴加BaCl2溶液,边滴加边震荡,滴加至溶液上层清液里不再出现沉淀即可停止滴加.
故答案为:
向盐酸和H2SO4的混合溶液中滴加BaCl2溶液,边滴加边振荡,滴加至溶液上层清液里不再出现沉淀即可停止滴加.
2.要除去CuSO4溶液中的H2SO4,实质就是除去氢离子,可利用硫酸与氧化铜粉末充分反应生成硫酸铜和水,能除去杂质且没有引入新的杂质,符合除杂原则.
使所加的BaCl2溶液接近“适量”,可向盐酸和H2SO4的混合溶液中滴加BaCl2溶液,边滴加边震荡,滴加至溶液上层清液里不再出现沉淀即可停止滴加.
故答案为:
| 选用试剂 | 操作方法 | |
| 1 | 稀盐酸 | 加入适量稀盐酸充分反应 |
| 2 | 氧化铜 | 加入氧化铜粉末充分反应后过滤 |
点评:物质的分离与除杂是中考的重点,也是难点,解决除杂问题时,抓住除杂质的必需条件(加入的试剂只与杂质反应,反应后不能引入新的杂质)是正确解题的关键.

练习册系列答案
相关题目
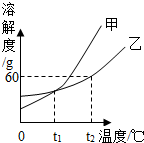 (2012?营口)图所示是甲、乙两种固体物质的溶解度曲线,请回答下列问题:
(2012?营口)图所示是甲、乙两种固体物质的溶解度曲线,请回答下列问题: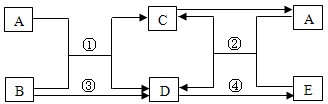 (2012?营口)A、D、E为氧化物,B、C为单质,C为紫红色金属.在一定条件下,他们的转化关系如图所示.请回答下列问题:
(2012?营口)A、D、E为氧化物,B、C为单质,C为紫红色金属.在一定条件下,他们的转化关系如图所示.请回答下列问题: