题目内容
根据图1和图2中A、B两种物质和氢氧化钙的溶解度曲线回答问题.
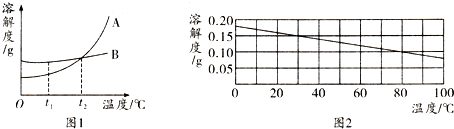
(1)分析图1,t1℃时,A、B两种物质的溶解度关系为A
(2)分析图2,在冬天气温为5℃时配制的氢氧化钙饱和溶液,在夏天气温为38℃时(水的蒸发或略不计),可能出现的情况是
(3)将t2℃时等质量的A、B饱和溶液降温到t1℃后,溶质质量分数较大的是

(1)分析图1,t1℃时,A、B两种物质的溶解度关系为A
<
<
B(填“>”、“<”或“=”),要使A、B的饱和溶液变成不饱和溶液,可采用的方法是:①增加溶剂
增加溶剂
;②升高温度
升高温度
.(2)分析图2,在冬天气温为5℃时配制的氢氧化钙饱和溶液,在夏天气温为38℃时(水的蒸发或略不计),可能出现的情况是
氢氧化钙的溶解度会减小,饱和溶液会析出晶体,溶液变浑浊,溶液中溶质的质量分数减小
氢氧化钙的溶解度会减小,饱和溶液会析出晶体,溶液变浑浊,溶液中溶质的质量分数减小
(从外观现象、溶质质量、溶质质量分数三方面描述).(3)将t2℃时等质量的A、B饱和溶液降温到t1℃后,溶质质量分数较大的是
B
B
.分析:(1)据溶解度曲线可比较某温度下不同物质的溶解度,饱和溶液变为不饱和溶液可用增加溶剂、升高温度的方法;
(2)据氢氧化钙的溶解度随温度变化情况分析解答;
(3)据饱和溶液在溶质的质量分数计算方法分析解答.
(2)据氢氧化钙的溶解度随温度变化情况分析解答;
(3)据饱和溶液在溶质的质量分数计算方法分析解答.
解答:解:(1)分析图1,t1℃时,A、B两种物质的溶解度关系为A<B,由于AB的溶解度均随温度的升高而增大,所以要使A、B的饱和溶液变成不饱和溶液,可采用增加溶剂、升高温度的方法;
(2)分析图2可知:氢氧化钙的溶解度随温度的升高而减小,所以在冬天气温为5℃时配制的氢氧化钙饱和溶液,在夏天气温为38℃时(水的蒸发或略不计),可能出现的情况是氢氧化钙的溶解度减小,析出晶体,溶液变浑浊,溶质减少,而溶剂的质量不变,故溶质的质量分数减小;
(3)AB的溶解度随温度的降低而减小,所以将t2℃时等质量的A、B饱和溶液降温到t1℃后,均析出晶体,由于饱和时质量分数的计算式
×100%,即溶解度大则溶质的质量分数大,降温至t1℃后,B的溶解度大于A的溶解度,故溶质质量分数较大的是B;
故答案为:(1)<;增加溶剂;升高温度;
(2)氢氧化钙的溶解度会减小,饱和溶液会析出晶体,溶液变浑浊,溶液中溶质的质量分数减小;
(3)B.
(2)分析图2可知:氢氧化钙的溶解度随温度的升高而减小,所以在冬天气温为5℃时配制的氢氧化钙饱和溶液,在夏天气温为38℃时(水的蒸发或略不计),可能出现的情况是氢氧化钙的溶解度减小,析出晶体,溶液变浑浊,溶质减少,而溶剂的质量不变,故溶质的质量分数减小;
(3)AB的溶解度随温度的降低而减小,所以将t2℃时等质量的A、B饱和溶液降温到t1℃后,均析出晶体,由于饱和时质量分数的计算式
| 溶解度 |
| 溶解度+100g |
故答案为:(1)<;增加溶剂;升高温度;
(2)氢氧化钙的溶解度会减小,饱和溶液会析出晶体,溶液变浑浊,溶液中溶质的质量分数减小;
(3)B.
点评:本题主要考查了溶解度曲线的意义及氢氧化钙的溶解度曲线的应用,饱和溶液中溶质的质量分数的计算方法,可培养学生应用知识解决问题的能力.

练习册系列答案
 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目