题目内容
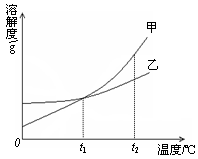
右图为氯化钠、碳酸钠在水中的溶解度曲线。请回答下列问题:

(1)氯化钠溶液中的溶质是 ;
(2)10℃时,碳酸钠的溶解度为 g;
(3)30℃时,氯化钠的溶解度 碳酸钠的溶解度(填写“>”、“<”或“=”);
(4)10℃时,向两只盛有100g水的烧杯中,分别加入氯化钠、碳酸钠两种物质,至不再溶解为止,所得溶液的溶质质量分数大的是 溶液(填化学式);
(5)如右图所示,20℃时,将盛有饱和碳酸钠溶液的小试管放入盛水的烧杯中,向水中加入某物质后,变为不饱和溶液。加入的物质可能是________(填字母序号)。


(1)氯化钠溶液中的溶质是 ;
(2)10℃时,碳酸钠的溶解度为 g;
(3)30℃时,氯化钠的溶解度 碳酸钠的溶解度(填写“>”、“<”或“=”);
(4)10℃时,向两只盛有100g水的烧杯中,分别加入氯化钠、碳酸钠两种物质,至不再溶解为止,所得溶液的溶质质量分数大的是 溶液(填化学式);
(5)如右图所示,20℃时,将盛有饱和碳酸钠溶液的小试管放入盛水的烧杯中,向水中加入某物质后,变为不饱和溶液。加入的物质可能是________(填字母序号)。

| A.氢氧化钠溶液 | B.生石灰 | C.硝酸铵 | D.稀硫酸 |
(1)氯化钠 (2)10 (3)= (4)NaCl (5)B
试题分析:根据固体的溶解度曲线分析。
(1)氯化钠溶液即氯化钠的水溶液,溶质是氯化钠,溶剂是水;
(2)根据碳酸钠的溶解度曲线可知,在10℃时,碳酸钠的溶解度10g;
(3)在30℃时,两物质的溶解度曲线交于一点,说明两物质的溶解度相等;
(4)在10℃时,由于氯化钠的溶解度大于碳酸钠的溶解度,根据某温度下,饱和溶液的溶质质量分数=
 ×100%可知,所以在10℃时,这两物质的饱和溶液中溶质的质量分数是氯化钠>碳酸钠;
×100%可知,所以在10℃时,这两物质的饱和溶液中溶质的质量分数是氯化钠>碳酸钠;(5)根据碳酸钠的溶解度曲线可知,碳酸钠的溶解度随温度的升高而明显增大,而现在碳酸钠的饱和溶液变为不饱和溶液,说明温度升高了,因此加入的物质应是溶于水放热的物质,或与水反应放热的物质,故选B。
点评:本题难度不大,主要考查了根据固体的溶解度曲线解决相关的问题,要记住:根据固体的溶解度曲线可以:①查出某温度下某物质的溶解度;②比较不同物质在同一温度下的溶解度大小,从而判断同温度下的饱和溶液中溶质的质量分数的大小;③判断出物质的溶解度随温度变化的变化情况,从而确定通过升温、降温还是蒸发溶剂的方法使溶质从溶液中结晶析出。

练习册系列答案
 名题金卷系列答案
名题金卷系列答案
相关题目