题目内容
【题目】海洋中蕴藏着丰富的化学资源,如NaCl、MgCl2、CaCl2等物质。从海水中提取金属镁的主要流程如下:
(1)电解熔融的无水MgCl2可以得到金属镁。该反应属于基本反应类型中的反应。
(2)将海水中的镁提取出来,首先要让海水中的镁离子形成沉淀而富集起来。结合表中数据分析,为了使氯化镁转化为沉淀,应加入溶液A可能是
室温下几种物质的溶解度
物质 | MgCO3 | CaCO3 | Mg(OH)2 | Ca(OH)2 |
溶解度/g | 0.01 | 0.0013 | 0.0029 | 0.16 |
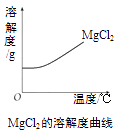
(3)结合MgCl2的溶解度曲线分析,操作I:蒸发浓缩、、过滤。
【答案】
(1)分解
(2)Ca(OH)2溶液或NaOH溶液
(3)降温结晶
【解析】(1)电解熔融的无水MgCl2可以得到金属镁和氯气,属于分解反应;
(2)依据溶解度图转化成Mg(OH)2更能把镁离子富集,氯化镁转化为氢氧化镁需要加入碱液以提供氢氧根,此处选择过量的Ca(OH)2溶液(或NaOH溶液)进行反应,目的是让所取海水中的氯化镁全部转化为氢氧化镁沉淀; 故A为Ca(OH)2溶液或NaOH溶液 ;
(3)MgCl2的溶解度随温度升高而增大,故降温结晶;
【考点精析】关于本题考查的固体溶解度曲线及其作用,需要了解1.查找指定温度时物质的溶解度,并根据溶解度判断溶解性.2.比较相同温度时(或一定温度范围内)不同物质溶解度的大小.3.比较和确定物质的溶解度受温度影响的程度,并据此确定物质结晶或混合物分离提纯的方法.4.确定溶液的状态(饱和与不饱和)才能得出正确答案.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目