题目内容
【题目】下列物质不可能是通过相应的金属跟稀酸发生置换反应制得的是( )
A.硫酸铁
B.硫酸锌
C.氯化镁
D.氯化亚铁
【答案】A
【解析】
金属与酸发生置换反应的条件:(1)对金属的要求,必须是金属活动性顺序中排在氢以前的金属;(2)对酸的要求,这里所指的酸并不是所有的酸,主要是指稀盐酸和稀硫酸;
硫酸锌可由锌与稀硫酸反应得到;铁与稀硫酸反应得到硫酸亚铁,不能生成硫酸铁;氯化镁由镁与盐酸发生置换反应直接得到.
故选A.

【题目】下表是某指示剂在一定pH范围内所显示的颜色:
颜色 | 红 | 橙 | 绿 | 蓝 | 紫 |
pH范围 | 1~3 | 4~7 | 6~7 | 8~10 | 11~14 |
向滴有少量该指示剂的稀硫酸中,加入氢氧化钠溶液,出现的颜色变化可能是( )
A.由红变紫
B.由蓝变绿
C.由绿变橙
D.由蓝变紫
【题目】某研究性学习小组在探究“锌与硫酸反应快慢的影响因素”时,发现一个意外现象,硫酸中混有硫酸铜溶液时,产生氢气的速率更快.
【提出问题】是什么离子导致产生氢气的速率加快?
(1)【猜想假设】他们分别对这种意外现象作如下猜想:
甲同学:可能与铜离子有关;
乙同学:可能与硫酸根离子有关;
丙同学认为乙的猜想不科学,理由是 .
(2)【实验证明】用A、B两组仪器进行实验: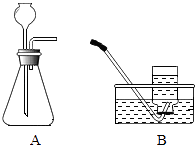
步骤一:检查装置气密性.检查图A所示装置气密性,你采用的方法是 .
步骤二:量取2份质量分数为20%的稀硫酸各20mL,第一份加入质量分数为10%的稀硫酸铜溶液1mL,第二份加入质量分数为10%的硫酸锌溶液1mL,称取2份形状相同锌粒各1g,分别与以上溶液反应,反应装置如图A所示,用此装置实验时,长颈漏斗下端要插入液面以下,目的是 .
实验三:用B收集气体,分别记录收集一瓶气体(集气瓶规格均为125mL)所需的时间(如表),什么时间开始收集气体? .
编号 | 20%的硫酸各20ml | 锌粒 | 收集1瓶氢气所需的时间 |
① | 加入质量分数为10%的硫酸铜溶液1ml | 1g | 2分10秒 |
② | 加入质量分数为10%的硫酸锌溶液1ml | 1g | 3分01秒 |
锌与硫酸反应的化学方程式是 .
(3)【得出结论】硫酸中混有硫酸铜溶液时,产生氢气的速率加快与有关,实验②中加入质量分数为10%的硫酸锌溶液1ml的作用是 .
(4)【反思质疑】丁同学认为:锌与混有硫酸铜的硫酸溶液反应时,产生氢气的速率较快可能与铜单质有关,他质疑的理由是 .
(5)【继续探究】请你设计一个实验方案验证丁同学的观点是否正确.
编号 | 实验步骤 | 实验现象比较 | 实验结论 |
① | 取1g锌粒于锥形瓶中,加入20ml20%的稀硫酸 | 产生氢气的速率较快与铜单质有关 | |
② |