题目内容
同学们在淡水养殖场参观时,好奇的发现农民向鱼池中撒一种微黄色的固体,咨询得知,这种固体的主要成分是过氧化钙(CaO2),它和水反应时产生氧气,以增加鱼池中氧气的含量.
同学们对过氧化钙和水反应的产物进行了探究:
[提出问题一]把少量过氧化钙投入足量水中,在产生氧气的同时还产生什么物质?
[猜想与验证一](1)小明同学认为:在产生氧气的同时还产生氧化钙
(2)小红同学认为:在产生氧气的同时还产生氢氧化钙
同学们认为小明的猜想不合理,理由是________;
请设计一个实验方案来验证小红的猜想是正确的,并填入下表空格中:

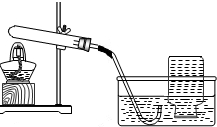
同学们已学习了氧气的实验室制法,于是他们又作了进一步的探究:
[提出问题二]在实验室,过氧化钙能否用于制取氧气?
[查阅资料]过氧化钙常温下稳定,300℃时能分解产生氧气;
[猜想与验证二]小明同学依据________,提出猜想
猜想:加热CaO2能用于实验室制取氧气
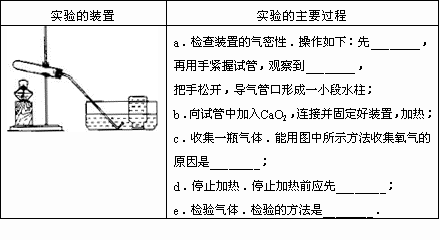
小明又联系到农民用过氧化钙增加鱼池中氧气的含量,提出猜想
猜想:过氧化钙和水反应能用于实验室制取氧气

[实验结论]加热CaO2能用于实验室制取氧气;CaO2和水反应不能用于制取氧气.
[分析与反思]用过氧化钙和水反应虽然收集不到大量的氧气,但由实验的现象分析,农民用过氧化钙和水反应以增加鱼池中氧气的含量的原因是________;
小明想改进实验以加快反应的速度,请你提出一条改进的方法________;
过氧化钠与水反应的原理:2Na2O2+2H2O=4NaOH+O2↑,且CaO2与Na2O2的化学性质非常相似.写出CaO2与H2O反应的化学方程式________.
解析:
|
[猜想与验证一]氧化钙能与水反应生成氢氧化钙,最终产物不可能是氧化钙
[猜想与验证一]过氧化钙在300℃时能分解产生氧气 a.将导气管放入水中 水中出现气泡 c.氧气难溶于水 d.将导气管从水中取出 e.将带火星的小木条伸入集气瓶中 [分析与反思] ①过氧化钙在水中能持续、缓慢产生氧气 ②加热过氧化钙和水的混合物(或加入催化剂)③2CaO2+2H2O=2Ca(OH)2+O2↑(每空1分) |


 23、(1)以下是同学们在学习溶液知识时实验报告中的部分内容,分析后请回答:
23、(1)以下是同学们在学习溶液知识时实验报告中的部分内容,分析后请回答: