题目内容
【题目】某化学探究小组设计了如下图所示的实验装置,用来测定空气中氧气的含量,使用细铜丝可防止生成的五氧化二磷泄露空气中污染环境。则回答:
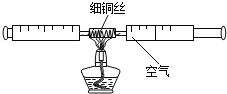
(1)在实验的加热过程中,交替缓慢推动两个注射器的目的是_____。
(2)该实验中红色的铜丝逐渐变成黑色氧化铜(CuO),该反应的化学表达式为_____。
(3)常温下,将100 mL的空气通过足量灼热的铜网,充分反应后,恢复到常温,则实验装置中余下气体的体积约为_____mL。
(4)该实验只是粗略测定空气中氧气含量的一种方法,你认为造成该实验不够精确的可能原因是(只需一种即可)_____。
【答案】让氧气充分反应 Cu+O2![]() CuO 80(或79) 铜丝量不足(或装置气密性不好)等
CuO 80(或79) 铜丝量不足(或装置气密性不好)等
【解析】
解:(1) 交替缓慢推动两个注射器的目的是使封闭空间的氧气与铜丝充分接触,使空气中的氧气与铜丝充分反应;
(2) 红色的铜丝逐渐变成黑色氧化铜(CuO),该反应的化学表达式为:Cu+O2![]() CuO;
CuO;
(3) 氧气约占空气体积的![]() ,实验结束后,注射器内的气体体积理论上应该减少约100mL×
,实验结束后,注射器内的气体体积理论上应该减少约100mL×![]() =20mL;剩余气体的体积为80 mL;
=20mL;剩余气体的体积为80 mL;
(4) 造成该实验出现误差的原因可能是:①在加热过程中没有推拉注射器、②读数时没有冷却至室温、③铜丝量不足、④装置漏气等。

【题目】做完“铁在氧气里燃烧”的实验后,某兴趣小组有一些疑惑不解的问题,于是进行了以下探究
【问题1】细铁丝在氧气中燃烧为什么会火星四射?
【资料1】铁制品一般含有少量碳,含碳细铁丝燃烧时,炭粒生成的二氧化碳在熔融态物质中形成气泡,熔融态物质因气泡炸裂引起火星四射现象.
【设计实验】为了探究火星四射现象的原因,该小组同学设计的实验方案:
【实验探究1】小明做细铁丝在氧气中燃烧的实验:
但不见铁丝燃烧,反复实验均未成功.写出导致该同学实验失败的可能原因(两个): 。
经过改进,该同学完成了该实验,写出反应的文字或符号表达式 。
【问题2】铁燃烧时溅落下来的黑色物质中还有没有铁?
【资料2】自然界中铁的氧化物主要有Fe2O3和Fe3O4两种(Fe2O3为暗红色,FeO极易氧化)。
【实验探究2】将冷却后的黑色物质碾碎,经实验,说明溅落下来的黑色物质中还有铁。
【问题3】铁燃烧的产物为什么不是Fe2O3呢?
【资料3】①Fe2O3和Fe3O4的分解温度见下表;②Fe2O3铁高温分解成Fe3O4
Fe3O4 | Fe2O3 | 铁 | |
分解温度/℃ | 1538 | 1400 | |
熔点点/℃ | 1535 |
【理论讨论】根据实验现象,并结合表中数据,可推知铁在氧气里燃烧时产生的高温在 之间。
【拓展延伸】①Fe2O3高温分解成Fe3O4和一种气体,写出该反应的文字或符号表达式 ;
②有些超市的食品包装盒放有黑色的氧化亚铁粉末,若粉末的颜色 ,就说明包装盒漏气,售货员就能及时发现并处理。
【题目】空气中氧气含量测定的再认识。
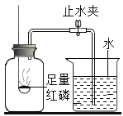
(实验回顾)如图是实验室用红磷燃烧来粗略测定空气中氧气含量的装置。
(1)写出红磷燃烧的化学式方程式:______________。
(2)实验原理:由于红磷燃烧消耗空气中的氧气使瓶内气体___________减小,烧杯中水倒吸到集气瓶中。若装置的气密性良好,操作规范,用量筒测量进入瓶中水的体积,能粗略测得空气中氧气的含量。
(问题提出)有实验资料表明:燃烧过程中当氧气体积分数低于7%时,红磷就无法继续燃烧,因此通过上述实验,测量结果与理论值误差较大。
(实验改进)
Ⅰ根据铁在空气中生锈的原理,设计如图实验装置,再次测定空气中氧气含量。

(说明:装置中饱和食盐水、活性炭会加速铁生锈。)
II.测得实验数据如下表。
测量项目 | 实验前 | 实验后 | |
烧杯中水的体积 | 烧杯中剩余水的体积 | 集气瓶(扣除内容物)和导管的容积 | |
体积/mL | 80.0 | 54.5 | 126.0 |
(交流表达)
(1)铁生锈过程发生复杂的化学反应,首先是铁与氧气、水反应生成氢氧化亚铁[Fe(OH)2],化学方程式为______,计算氢氧化亚铁[Fe(OH)2]的相对分子质量Mr [Fe(OH)2] =_______。
(2)根据上表数据进行计算,改进实验后测得的空气中氧气的体积分数是______(计算结果精确到0.1%)。
(3)从实验原理角度分析,改进后的实验结果比前者准确度更高的原因是:①______;②______。